Luận án Nghiên cứu công nghệ sản xuất chè đen giàu gama aminobutyric acid bằng kỹ thuật lên men từ một số giống chè Việt Nam

Trang 1

Trang 2

Trang 3

Trang 4

Trang 5

Trang 6

Trang 7

Trang 8

Trang 9
Trang 10
Tải về để xem bản đầy đủ
Bạn đang xem 10 trang mẫu của tài liệu "Luận án Nghiên cứu công nghệ sản xuất chè đen giàu gama aminobutyric acid bằng kỹ thuật lên men từ một số giống chè Việt Nam", để tải tài liệu gốc về máy hãy click vào nút Download ở trên.
Tóm tắt nội dung tài liệu: Luận án Nghiên cứu công nghệ sản xuất chè đen giàu gama aminobutyric acid bằng kỹ thuật lên men từ một số giống chè Việt Nam

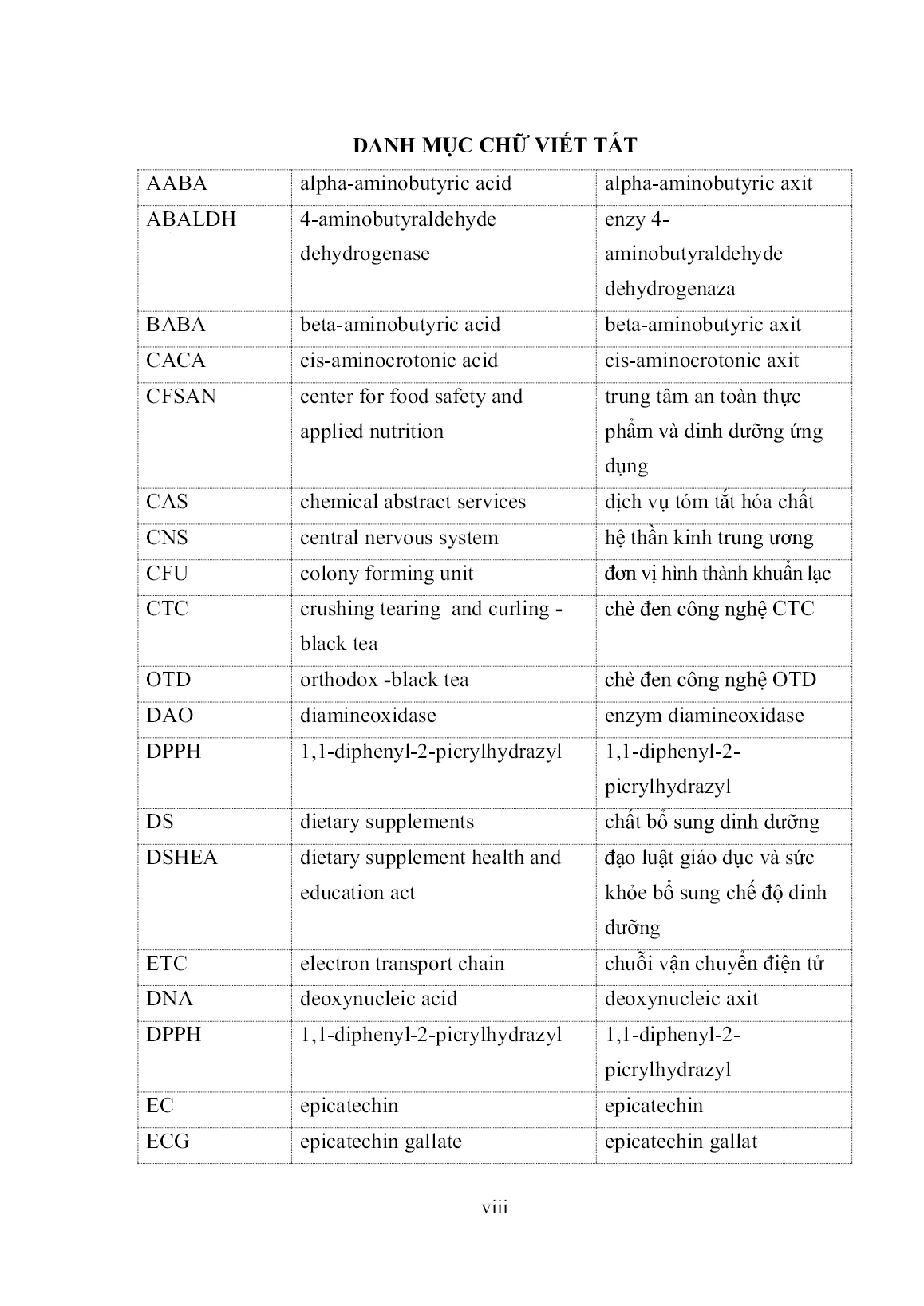
chủng vi khuẩn lactic 67 (bar 5µm) 3.1.2.2. Phân loại vi khuẩn dựa trên phân tích trình tự rRNA DNA tổng số của các chủng vi khuẩn được tách chiết và làm khuôn cho phản ứng PCR bằng cặp mồi đã thiết kế. Sản phẩm PCR được tinh sạch và làm 61 mẫu cho phản ứng khuếch đại tiếp với các mồi và chất huỳnh quang của Kit Cycle sequencing. Trình tự nucleotide của đoạn gen mã hóa rRNA 16S được xác định (xem thêm ở Phụ lục 1) và được so sánh với các trình tự đã được công bố trên ngân hàng gen Quốc tế. Cây phát sinh chủng loại của 4 chủng lựa chọn và 29 loài thuộc chi Lactobacillus được xây dựng dựa vào trình tự rRNA 16S; Weissella viridescens được sử dụng làm nhóm ngoài (Hình 3.5). Quan sát cây phát sinh cho thấy 4 chủng nghiên cứu chia làm ba nhóm: 2 chủng 66 và 67 nằm trên vị trí phân loại với nhóm Lactobacillus brevis. Chủng VTCC-B-439 nằm cùng vị trí với các loài L.plantarum; chủng VTCC-B-411 nằm cùng với các loài thuộc nhóm L.casei. Kết quả so sánh trình tự cho thấy chủng 66 và 67 có quan hệ gần gũi nhất với loài L.brevis M58810 với độ tương đồng đoạn rDNA 16S là 99,9%. Chủng VTCC-B-439 có quan hệ gần gũi nhất với loài L.plantarum D79210 với độ tương đồng là 99,4%. Chủng VTCC-B-411có độ tương đồng đoạn ADNr 16S là 100% vớiLactobacillus casei M177140. Như vậy, dựa vào hình thái và trình tự rRNA 16S, các chủng 66 và 67 được định tên là Lactobacillus brevis; chủng VTCC-B-439 là Lactobacillus plantarum; chủng VTCC-B-411 được phân loại vào loài Lactobacillus casei. Đây là các chủng vi khuẩn lactic an toàn và thường được sử dụng trong thực phẩm. Hầu hết các chủng vi khuẩn lên men lactic (LAB) trong bộ sưu tập 263 chủng mà đề tài luận án sử dụng đều có nguồn gốc từ thực phẩm lên men hoặc các nguồn chứa axit glutamic khác. Trong nghiên cứu của luận án, năng suất cao nhất của LAB tạo ra GABA là chủng L. casei VTCC-B-411 và L.plantarum VTCC-B-439, cao hơn 2 chủng L. brevis 66 và L. brevis 67. Kết quả này là phù hợp với rất nhiều báo cáo trước đây. 62 Hình 3.5. Cây phát sinh chủng loại của 4 chủng nghiên cứu và một số loài có quan hệ họ hàng gần thuộc chi Lactobacillus dựa vào trình tự rRNA 16S Nhiều chủng LAB tạo GABA từ các nguồn khác nhau như L. plantarum L10-11 được phân lập từ plaa-som (cá lên men của Thái Lan) [147], L. pentosus SS6 được phân lập từ quả dâu tằm lên men [141], Compani-lactobacillus futsaii CS3 được phân lập từ tôm lên men của Thái Lan hoặc Kung-Som [148], 63 Latilactobacillus sakei A156 được phân lập từ hải sản lên men của Hàn Quốc hoặc Jeot-gal [149], ba chủng L. brevis và một trong số Lactococcus lactis được phân lập từ pho mát Tây Ban Nha [150], năm chủng bao gồm L. plantarum, L. brevis, Leuconostoc mesenteroides, Leuconostoc lactis và Weissella viridescens được phân lập từ kim chi [68]. Trong nghiên cứu của luận án có một sự khác biệt so với kết quả của Kanklai và cộng sự [146], nhóm tác giả đó cho biết khả năng sinh GABA của L. brevis F064A được phân lập từ xúc xích lên men (Sai Krok Isan) cao hơn của các chủng L. plantarum. Điều này chứng tỏ ngay cả cùng một giống, chủng nhưng khả năng tổng hợp GABA vẫn có thể khác nhau, tùy thuộc vào enzym glutamate decarboxylase và nhiều yếu tố khác. 3.1.3. Thử nghiệm khả năng lên men tạo GABA trên lá chè Mục đích của nghiên cứu là chứng minh các chủng giống nêu ở trên không những có khả năng tổng hợp GABA trong môi trường nuôi cấy nhân tạo mà còn có thể sinh trưởng và sinh GABA trên lá chè. Các chủng này nếu có khả năng như thế mới có thể sử dụng cho ứng dụng vào sản xuất chè giàu GABA. Thí nghiệm được thực hiện theo phương pháp trình bày tại mục 2.3.1.2. Theo đó, các chủng Lactobacillus được nuôi cấy trong môi trường MRS ở 37oC trong 24 h. Bổ sung 10% thể tích giống nuôi cấy vào trong các túi chè. Mỗi ngày lấy ra 3 g chè để xác định hàm lượng GABA trong dịch chiết chè bằng phương pháp quang phổ. Kết quả xác định hàm lượng GABA nêu trong Bảng 3.2. Từ kết quả trong bảng cho thấy cả 4 chủng nghiên cứu đều có khả năng tạo GABA với hàm lượng khác nhau trong cả 3 ngày thử nghiệm lên men. Chủng VTCC-B-439 và VTCC-B-411 có khả năng tạo GABA trên chè cao nhất sau 2 ngày, đạt trên 0,8 mg/ml. Chủng 66 và chủng 67 có khả năng tạo GABA trên chè thấp hơn, chỉ khoảng 0,3 mg/ml. Cả 4 chủng đều tạo GABA trên chè cao sau 2 ngày lên men và sau đó hàm lượng GABA không tăng nữa. Như vậy, 64 sau kết quả thử nghiệm khả năng lên men tạo GABA trên chè của 4 chủng vi khuẩn lactic, 2 chủng VTCC-B-439 và chủng VTCC-B-411 có khả năng tạo GABA cao nhất được lựa chọn. Bảng 3.2. Khả năng lên men tạo GABA trên chè của 4 chủng vi khuẩn Chủng vi khuẩn Hàm lượng GABA (mg/ml) 1 ngày 2 ngày 3 ngày L. plantarum (VTCC-B-439) 0,421 0,888 0,897 L. casei (VTCC-B-411) 0,359 0,813 0,815 L. brevis (66) 0,233 0,301 0,289 L. (67) 0,267 0,323 0,331 3.1.4. Xác định chế độ công nghệ sản xuất sinh khối vi khuẩn lactic để lên men chè giàu GABA 3.1.4.1. Lựa chọn môi trường và thời gian nuôi cấy thích hợp Các khảo sát ở mục 3.1.4 nhằm xác định các thông số kỹ thuật như loại môi trường, nhiệt độ, thời gian, pH, điều kiện cung cấp ô xy cho môi trường nuôi cấy, tỷ lệ giống lên men, và lựa chọn nguồn ni tơ, cacbon để sản xuất giống phục vụ cho lên men tạo sản phẩm chè đen giàu GABA. Các thí nghiệm được bố trí theo phương pháp đã trình bày tại mục 2.3.1.3. Hai chủng vi khuẩn VTCC-B-439 và VTCC-B-411 được nuôi trong các môi trường dịch thể được kí hiệu MT1, MT2, MT3, MT4, MT5, MT6, MT7 và MT8 bổ sung 1% glutamate ở nhiệt độ 37oC. Sau 24, 48, 72 và 102 h nuôi cấy, tiến hành xác định mật độ tế bào bằng cách đo mật độ quang ở bước sóng 600 nm (OD600) và định lượng GABA trong dịch nuôi cấy. Kết quả xác định mức độ sinh trưởng (qua mật độ quang) và hàm lượng GABA của chủng vi khuẩn VTCC-B-439 và chủng vi khuẩn VTCC-B-411 được nêu trong Bảng 3.3 và Bảng 3.4. 65 Bảng 3.3. Khả năng sinh trưởng và hàm lượng GABA trong 8 môi trường nuôi cấy chủng vi khuẩn VTCC-B-439 Môi trường Chủng VTCC-B-439 24 h 48 h 72 h 102h OD600 GABA (mg/ml) OD600 GABA (mg/ml) OD600 GABA (mg/ml) OD600 GABA (mg/ml) MT1 2,376 0,428 2,987 0,5583 3,246 0,523 3,321 0,499 MT2 2,729 0,633 3,286 0,8149 3,286 0,703 3,280 0,623 MT3 1,416 0,312 2,094 0,323 2,297 0,349 0,886 0,312 MT4 1,407 0,232 1,477 0,303 1,564 0,289 1,012 0,200 MT5 1,458 0,334 1,881 0,412 1,982 0,387 1,189 0,235 MT6 1,585 0,314 1,879 0,328 1,812 0,322 2,043 0,212 MT7 1,262 0,413 0,824 0,545 0,801 0,468 0,365 0,321 MT8 1,519 0,424 0,689 0,591 0,768 0,521 1,110 0,323 Dựa vào kết quả Bảng 3.3 và Bảng 3.4 thấy hai chủng được nuôi trên 8 loại môi trường khác nhau có mật độ tế bào và hàm lượng GABA ở các mức độ khác nhau tùy thuộc vào môi trường và thời gian nuôi cấy. Khi nuôi cấy chủng trong môi trường MT1 và MT2 khả năng sinh trưởng và hàm lượng GABA của 2 chủng đều cao (OD600 > 2,7, hàm lượng GABA đạt trên 0,5 mg/ml. So sánh giữa 2 môi trường này thấy MT1 cho khả năng sinh trưởng tốt hơn môi trường MT2. Trong khí MT2 cho khả năng tạo hàm lượng GABA cao hơn MT1. Đánh giá rằng sự khác biệt về hàm lượng GABA của MT2 là rất đáng kể, do vậy môi trường MT2 được coi là thích hợp để lựa chọn làm môi trường trong các nghiên cứu tiếp theo cho cả hai chủng. Cũng từ 2 bảng nêu trên thấy 48 h là thời gian lên men thích hợp của cả 2 chủng vi khuẩn lactic VTCC-B-439 và VTCC-B-411 trong cả 2 môi trường MT1 và MT2. 66 Bảng 3.4. Khả năng sinh trưởng và hàm lượng GABA trong 8 môi trường nuôi cấy chủng vi khuẩn VTCC-B-411 khác nhau Môi trường Chủng VTCC-B-411 24 h 48 h 24 h 102 h OD600 GABA (mg/ml) OD600 GABA (mg/ml) OD600 GABA (mg/ml) OD600 GABA (mg/ml) M1 3,285 0,523 3,405 0,6191 3,345 0,592 3,319 0,411 MT2 2,831 0,602 3,136 0,8013 3,332 0,699 3,279 0,599 MT3 1,373 0,311 1,776 0,311 2,129 0,315 1,889 0,301 MT4 1,298 0,241 1,292 0,297 1,256 0,267 1,058 0,225 MT5 1,462 0,329 1,946 0,378 2,002 0,336 0,963 0,216 MT6 1,686 0,327 1,809 0,397 1,987 0,364 2,011 0,217 MT7 1,142 0,439 1,724 0,599 1,977 0,432 1,217 0,304 MT8 1,553 0,436 1,535 1,545 0,562 0,537 0,664 0,334 3.1.4.2. Lựa chọn nhiệt độ nuôi cấy thích hợp Hai chủng vi khuẩn lactic VTCC-B-439 và VTCC-B-411 được nuôi trong môi trường thích hợp đã chọn MT2 ở các nhiệt độ khác nhau 20, 25, 30, 35, 40, 45, 50 và 55oC sau 24 h thì đo mật độ quang học OD. Kết quả được nêu trên Hình 3.6. Dựa vào số liệu trên hình cho thấy mật độ tế bào của 2 chủng khi được nuôi cấy ở điều kiện nhiệt độ khác nhau là khác nhau. Giá trị OD của các chủng vi khuẩn đạt giá trị cao nhất ở khoảng 30oC-40oC (OD > 2). Khi nuôi ở nhiệt độ dưới 30oC và trên 45oC, OD của các chủng giảm mạnh (OD < 1). Hai chủng vi khuẩn VTCC-B-439 và VTCC-B-411 sinh trưởng tốt trong khoảng nhiệt độ từ 30oC đến 40oC và cao nhất ở nhiệt độ 35oC (giá trị OD tương ứng của 2 chủng là 2,768 và OD 2,677). Dựa vào kết quả này, chọn nhiệt độ 35oC là nhiệt độ thích hợp cho thí nghiệm tiếp theo. 67 Hình 3.6. Mức độ sinh trưởng của vi khuẩn lactic VTCC-B-439 và VTCC-B-411 ở các nhiệt độ khác nhau 3.1.4.3. Lựa chọn pH nuôi cấy thích hợp Hai chủng vi khuẩn được nuôi trong các môi trường dịch thể MT2 ở 35oC với dải pH khác nhau có giá trị từ 4 - 8. Sau 24 h nuôi cấy, kiểm tra khả năng sinh trưởng của các chủng bằng phương pháp đo OD600. Kết quả được thể hiện ở Bảng 3.5. Bảng 3.5. Mức độ sinh trưởng và pH môi trường sau nuôi cấy của hai chủng nghiên cứu ở pH khác nhau Chủng pH môi trường nuôi cấy 4 5 6 7 8 OD600 pH OD600 pH OD600 pH OD600 pH OD600 pH VTCCB439 1,434 4,18 1,989 4,76 2,767 4,95 2,539 4,31 1,989 5,75 VTCCB411 1,589 4,01 2,231 4,25 2,789 3,970 2,601 4,02 2,014 5,10 Theo bảng thấy hai chủng nghiên cứu có khả năng sinh trưởng tốt nhất ở khoảng pH từ 6-7, giảm nhẹ pH 5 và pH 8, giảm mạnh ở pH 4. Môi trường có pH trước và sau nuôi khác nhau rõ rệt. Sau quá trình nuôi cấy, các môi trường pH cao có xu hướng giảm pH về giá trị pH axit. Trong khi đó, mật độ tế bào 0 0.5 1 1.5 2 2.5 3 20 25 30 35 40 45 50 55 O D 6 0 0 Nhiệt độ (oC) VTCCB439 VTCCB411 68 cũng đạt các giá trị khác nhau và đạt giá trị cao nhất tại pH 6 (OD > 2,7) cho cả 2 chủng. Dựa vào kết quả này, pH 6 để đề xuất là thích hợp và sử dụng trong các thí nghiệm tiếp theo. 3.1.4.4. Lựa chọn điều kiện cung cấp khí Hai chủng vi khuẩn được nuôi cấy ở môi trường nuôi cấy thích hợp, pH 6, nhiệt độ 35oC ở các điều kiện cung cấp khí khác nhau như: nuôi lắc, nuôi tĩnh, nuôi vi hiếu khí. Nhìn vào hình 3.7 thấy ở điều kiện nuôi tĩnh mật độ tế bào của các chủng nghiên cứu đạt giá trị cao nhất (2,656 với chủng VTCC-B-439 và 2,699 với chủng VTCC-B-411). Tuy nhiên, ở điều kiện nuôi lắc và nuôi vi hiếu khí, mật độ tế bào của các chủng nghiên cứu cũng tương đối cao có giá trị OD > 2,4 nhưng vẫn thấp hơn điều kiện nuôi cấy tĩnh. Vì vậy điều kiện nuôi tĩnh là thích hợp cho 2 chủng vi khuẩn lactic. Hình 3.7. Mức độ sinh trưởng của hai chủng nghiên cứu VTCC-B-439 và VTCC-B-411 ở các điều kiện cung cấp khí khác nhau 3.1.4.5. Lựa chọn tỷ lệ giống thích hợp Các chủng vi khuẩn lactic được nuôi tĩnh trên môi trường MT2, pH 6, ở nhiệt độ 35oC với các tỷ lệ giống cấy khác nhau là 0,5; 1,0; 3,0; 5,0; 7,0; 10%. 2.25 2.3 2.35 2.4 2.45 2.5 2.55 2.6 2.65 2.7 Nuôi lắc Nuôi tĩnh Nuôi vi hiếu khí O D 6 0 0 VTCCB439 VTCCB411 69 Sau 24 h nuôi cấy, kiểm tra mật độ tế bào của các chủng vi khuẩn. Kết quả được thể hiện ở Hình 3.8. Dựa vào số liệu trên hình thấy rằng khi tăng tỷ lệ giống cấy từ 0,5-5,0% khả năng sinh trưởng của hai chủng nghiên cứu đều tăng. Với tỷ lệ giống cấy 5,0%, các chủng có giá trị OD đạt mức cao nhất. Tuy nhiên, khi tỷ lệ giống tăng vượt quá 5,0%, mật độ tế bào của cả 2 chủng có xu hướng giảm. Do vậy, tỷ lệ giống cấy là 5,0% được chọn cho thí nghiệm tiếp theo. Hình 3.8. Mức độ sinh trưởng của 2 chủng nghiên cứu VTCC-B-439 và VTCC-B-411 ở các tỷ lệ giống khác nhau 3.1.4.6. Lựa chọn nguồn nitơ thích hợp Chuẩn bị môi trường nuôi cấy dịch thể của môi trường MT2 với nguồn nitơ cao nấm men được thay thế bởi các nguồn nitơ khác nhau như: cao thịt, pepton, tryptone, urea, NH4+; NO2 -, NO3 -. Các chủng vi khuẩn được nuôi tĩnh ở nhiệt độ 35oC trong vòng 24 h. Đánh giá mật độ tế bào của chúng khi nuôi ở các nguồn nitơ khác nhau. Kết quả được thể hiện trên Hình 3.9. Từ kết quả ở hình cho thấy các chủng vi khuẩn được nuôi trong nguồn nitơ hữu cơ thì có mật độ tế bào cao hơn nguồn nitơ vô cơ. Khi không bổ sung nguồn nitơ, khả năng sinh trưởng của các chủng rất kém. Khả năng sinh trưởng của vi khuẩn yếu 0 0.5 1 1.5 2 2.5 3 0.5 1.0 3.0 5.0 7.0 10.0 O D 6 0 0 Tỷ lệ giống cấy (%) VTCCB439 VTCCB411 70 trong nguồn nitơ NO2-, NO3-. Khả năng sinh trưởng thể hiện mạnh ở môi trường chứa nguồn nitơ cao men, cao thịt và pepton. Nhưng khả năng sinh trưởng tốt nhất ở nguồn nitơ cao men (Đc (+)) (OD của cả 2 chủng > 2,7). Vì vậy, nguồn nitơ là cao nấm men được chọn cho các thí nghiệm tiếp theo. Hình 3.9. Mức độ sinh trưởng của hai chủng nghiên cứu VTCC-B-439 và VTCC-B-411 trên các nguồn nitơ khác nhau 3.1.4.7. Lựa chọn nguồn carbon thích hợp Chuẩn bị môi trường MT2 với nguồn glucose được thay thế bằng các nguồn carbon ở các dạng khác nhau: galactose, saccharose, maltose, mannitol và lactose. Kết quả nêu trên Hình 3.10 cho thấy khả năng sinh trưởng của các chủng vi khuẩn khi nuôi trên các nguồn carbon khác nhau rất khác nhau. Trong đó, hai chủng nghiên cứu có xu hướng sinh trưởng tốt ở các nguồn carbon như saccharose, lactose, glucose (Đc+). Tuy nhiên, khả năng sinh trưởng tốt nhất khi vi khuẩn được nuôi trên nguồn carbon là lactose. Vì vậy, lactose được chọn là nguồn carbon thích hợp cho các nghiên cứu tiếp theo. 0 0.5 1 1.5 2 2.5 3 O D 6 0 0 VTCCB439 VTCCB411 71 Hình 3.10. Mức độ sinh trưởng của hai chủng nghiên cứu VTCC-B-439 và VTCC-B-411 trên các nguồn cacbon khác nhau Hình 3.11. Mật độ tế bào của các chủng nghiên cứu nuôi cấy trên môi trường có tỷ lệ glutamate khác nhau 3.1.4.8. Lựa chọn tỷ lệ glutamate thích hợp Các chủng vi khuẩn được nuôi ở môi trường MT2 có lượng glutamate khác nhau thay đổi trong khoảng 0-5,0% ở 35oC trong vòng 24 h. Sau đó đo OD của các chủng vi khuẩn lactic. Kết quả được thể hiện ở Hình 3.11. Dựa vào số liệu trên hình cho thấy, ở các tỷ lệ glutamate từ 0-1%, mật độ tế bào của hai chủng 0 0.5 1 1.5 2 2.5 3 Đc(+) Đc(-) galactose lactose maltose mannitol saccharose O D 6 0 0 VTCCB439 VTCCB411 0 0.5 1 1.5 2 2.5 3 3.5 4 0 0.1 0.5 1 2 3 5 O D 6 0 0 Tỷ lệ glutamate (%) VTCCB439 VTCCB411 72 xấp xỉ ngang bằng nhau. Mật độ tế bào đạt giá trị cao nhất tại tỷ lệ glutamate là 1%. Tuy nhiên, khi nuôi cấy ở môi trường có tỷ lệ glutamate >1%, khả năng sinh trưởng của các chủng giảm dần. Vì vậy, đề xuất chọn tỷ lệ glutamate 1% bổ sung vào môi trường nuôi cấy trong các thì nghiệm tiếp theo. 3.1.5. Tối ưu hóa quá trình nuôi cấy vi khuẩn lactic Các ảnh hưởng đơn yếu tố tới quá trình sinh trưởng của vi khuẩn đã được khảo sát trong mục 3.1.4. Một số đơn yếu tố như nhiệt độ, pH môi trường và thời gian nuôi cấy có khả năng cao có tác động tương hỗ với nhau. Vì vậy mục đích của nghiên cứu ở mục 3.1.5 là tối ưu hóa qúa trình thông qua 3 yếu tố vừa nêu. Các thông số khác thu được từ những thí nghiệm đã trình bày ở mục 3.1.4 được duy trì cố định: Môi trường nuôi cấy MT2, điều kiện nuôi cấy tĩnh, hàm lượng glutamat bổ sung: 1,0%; nguồn cacbon nuôi cấy: lactose; nguồn nitơ nuôi cấy: cao nấm men; tỷ lệ giống khởi động: 5,0% để làm môi trường lên men. Như vậy, quá trình tối ưu hóa được khảo sát tới 3 yếu tố: x1- thời gian nuôi cấy vi khuẩn, khoảng dao động của yếu tố này là từ 40 đến 56 h. x2- nhiệt nuôi cấy vi khuẩn, dao động trong khoảng 30 - 40oC. x3- pH môi trường lên men, dao động trong khoảng 5 - 8. Chỉ tiêu cần tối ưu là sinh khối vi khuẩn tạo thành, thể hiện qua mật độ quang OD đo ở bước sóng 600 nm (OD600). (a) Nội dung và phương pháp nghiên cứu tối ưu hóa: - Lập ma trận thực nghiệm trực giao cấp 1. - Thực hiện thực nghiệm theo ma trận và xây dựng hàm hồi quy: y = b0 + b1�̃�1 + b2�̃�2 + b3�̃�3 Trong đó, y: OD600 của môi trường lỏng nuôi cấy; b0: hệ số tự do; b1, b2, b3: các hệ số. - Kiểm định số liệu thực nghiệm, kiểm định sự có ý nghĩa của hệ số, kiểm nghiệm sự thích ứng của mô hình. 73 - Lập ma trận để tiến hành tối ưu hóa theo phương pháp Box-Willson. - Tiến hành thực nghiệm để kiểm định kết quả tối ưu hóa. (b) Kết quả thực nghiệm xây dựng mô hình: Ma trận thực nghiệm là ma trận trực giao với số thí nghiệm cần thực hiện N=23, trong đó số 2 là số mức mà mỗi yếu tố thực hiện thí nghiệm, số 3 là số yếu tố ảnh hưởng. Phương trình hồi quy có dạng : y = OD600 = b0 + b1�̃�1 + b2�̃�2 + b3�̃�3 (1). Trong đó: OD600: là mật độ quang của môi trường, b0: hệ số tự do �̃�i: (i=1÷3): biến số mã (biến số Kod) của các yếu tố ảnh hưởng. bi (i=1÷3): là hệ số hồi quy của các biến. Các biến ảnh hưởng có các mức như sau: �̅�1 = 40 h, 𝑥1 0 = 48 h, 𝑥1 + = 56 h �̅�2 = 30oC, 𝑥2 0 = 35oC, 𝑥2 + = 40oC �̅�3 = 5, 𝑥3 0 = 6,5, 𝑥3 + = 8 Với ma trận trực giao cấp 1, mỗi yếu tố ảnh hưởng chỉ thực hiện ở mức âm (-) và mức dương (+). Ma trận thực nghiệm bao gồm 8 thí nghiệm. Kết quả thí nghiệm được thể hiện ở Bảng 3.6. Bảng 3.6. Kết quả thực nghiệm theo ma trận (mỗi thí nghiệm lặp lại 3 lần, y là OD600) TT x1 x2 x3 y1 y2 y3 �̅� 𝑺𝒋 𝟐 1 +(56) +(40) +(8) 2,42 2,44 2,45 2,43 0,0002 2 -(40) +(40) +(8) 2,62 2,61 2,65 2,63 0,0004 3 +(56) -(30) +(8) 3,24 3,24 3,27 3,25 0,0003 4 -(40) -(30) +(8) 2,92 2,92 2,96 2,94 0,0004 5 +(56) +(40) -(5) 2,06 2,06 2,09 2,07 0,0003 6 -(40) +(40) -(5) 1,62 1,62 1,66 1,64 0,0004 7 +(56) -(30) -(5) 2,20 2,20 2,26 2,23 0,0005 8 -(40) -(30) -(5) 1,83 1,83 1,86 1,84 0,0003 ∑𝑆𝑗 2 = 0,0029 74 Bước 1: Kiểm tra sự hội tụ của sai số Mục đích của bước này là để kiểm định xem số liệu thu được ở Bảng 3.6 có được đo cùng một độ chính xác hay không. Nếu được đo cùng một độ chính xác như nhau, thì ta nói sai số là hội tụ, lúc đó số liệu ở Bảng 3.6 chấp nhận được. Tiêu chuẩn để đánh giá sự hội tụ sai số của số liệu là chuẩn Cocren: GTT ≤ GB, ở đây: GTT là chuẩn Cocren theo tính toán, GB là chuẩn Cocren tra bảng. 𝐺𝑇𝑇 = ∑ 𝑆𝑗 2 𝑁 = 0,0029 8 = 0,0003 𝑁 𝑗=1 GB = 0,56. Ta thấy GB > GTT Kết luận: Số liệu ở Bảng 3.6 được đo cùng một độ chính xác như nhau và chấp nhận được. Bước 2: Tính các hệ số của phương trình hồi quy Các hệ số được tính theo công thức: 𝑏0 = ∑ 𝑦�̅� 𝑁 = 19,03 8 = 2,38 𝑁 𝑗=1 𝑏1 = 1 8 ∑ 𝑦�̅�. 𝑥1�̃� = (2,43 − 2,63 + 3,25 − 2,94 + 2,07 − 1,64 + 2,23 − 1,84) 8 𝑁 𝑗=1 = 0,12 𝑏2 = 1 8 ∑ 𝑦�̅�. 𝑥2�̃� = −0,31 𝑁 𝑗=1 𝑏3 = 1 8 ∑ 𝑦�̅�. 𝑥3�̃� = 0,43 𝑁 𝑗=1 Mô hình hồi quy có dạng: y = 2,38 + 0,12�̃�1 - 0,31�̃�2 + 0,43�̃�3 (2). 75 Bước 3: Kiểm tra sự có ý nghĩa của các hệ số trong mô hình và kiểm tra sự tương thích của mô hình Mục đích của 2 bước kiểm tra này là để đánh giá: 1- Tác động của các biến ứng với các hệ số của nó có ý nghĩa đối với giá trị của y hay không. Nếu không có ý nghĩa thì sự có mặt của hệ số đó trong mô hình là vô nghĩa ; 2- Mô hình tính toán được có phản ánh đúng quy luật thay đổi của số liệu trong bảng 3.5 hay không. Ứng với một giá trị của các yếu tố ảnh hưởng ta nhận được hai giá trị của y : một giá trị từ số liệu thực nghiệm và một giá trị tính toán theo mô hình. Nếu sai lệch giữa hai giá trị của y đủ bé thì mô hình xây dựng được là thích ứng. Để đánh giá sự có ý nghĩa của các hệ số trong mô hình ta dùng chuẩn Student, còn để đánh giá sự tương thích của mô hình, ta dùng chuẩn Fisher. Theo phương pháp của Phạm Việt Cường & Hoàng Đình Hòa (2009)
File đính kèm:
 luan_an_nghien_cuu_cong_nghe_san_xuat_che_den_giau_gama_amin.pdf
luan_an_nghien_cuu_cong_nghe_san_xuat_che_den_giau_gama_amin.pdf Công văn đăng thông tin bảo vệ luận án tiến sĩ.pdf
Công văn đăng thông tin bảo vệ luận án tiến sĩ.pdf CV đề nghị đăng toàn văn.pdf
CV đề nghị đăng toàn văn.pdf Thông báo về việc Bảo vệ luận án tiến sĩ cấp Viện.pdf
Thông báo về việc Bảo vệ luận án tiến sĩ cấp Viện.pdf Tom tat luấn án.pdf
Tom tat luấn án.pdf Trích yếu Luận án tiếng Việt và tiếng Anh.pdf
Trích yếu Luận án tiếng Việt và tiếng Anh.pdf

