Luận án Nghiên cứu công nghệ thu nhận một số hợp chất có hoạt tính sinh học từ hai loài nấm thượng hoàng (phellinus igniarius và phellinus nilgheriensis) ở Việt Nam, ứng dụng trong thực phẩm

Trang 1

Trang 2

Trang 3

Trang 4

Trang 5

Trang 6

Trang 7

Trang 8
Trang 9
Trang 10
Tải về để xem bản đầy đủ
Bạn đang xem 10 trang mẫu của tài liệu "Luận án Nghiên cứu công nghệ thu nhận một số hợp chất có hoạt tính sinh học từ hai loài nấm thượng hoàng (phellinus igniarius và phellinus nilgheriensis) ở Việt Nam, ứng dụng trong thực phẩm", để tải tài liệu gốc về máy hãy click vào nút Download ở trên.
Tóm tắt nội dung tài liệu: Luận án Nghiên cứu công nghệ thu nhận một số hợp chất có hoạt tính sinh học từ hai loài nấm thượng hoàng (phellinus igniarius và phellinus nilgheriensis) ở Việt Nam, ứng dụng trong thực phẩm

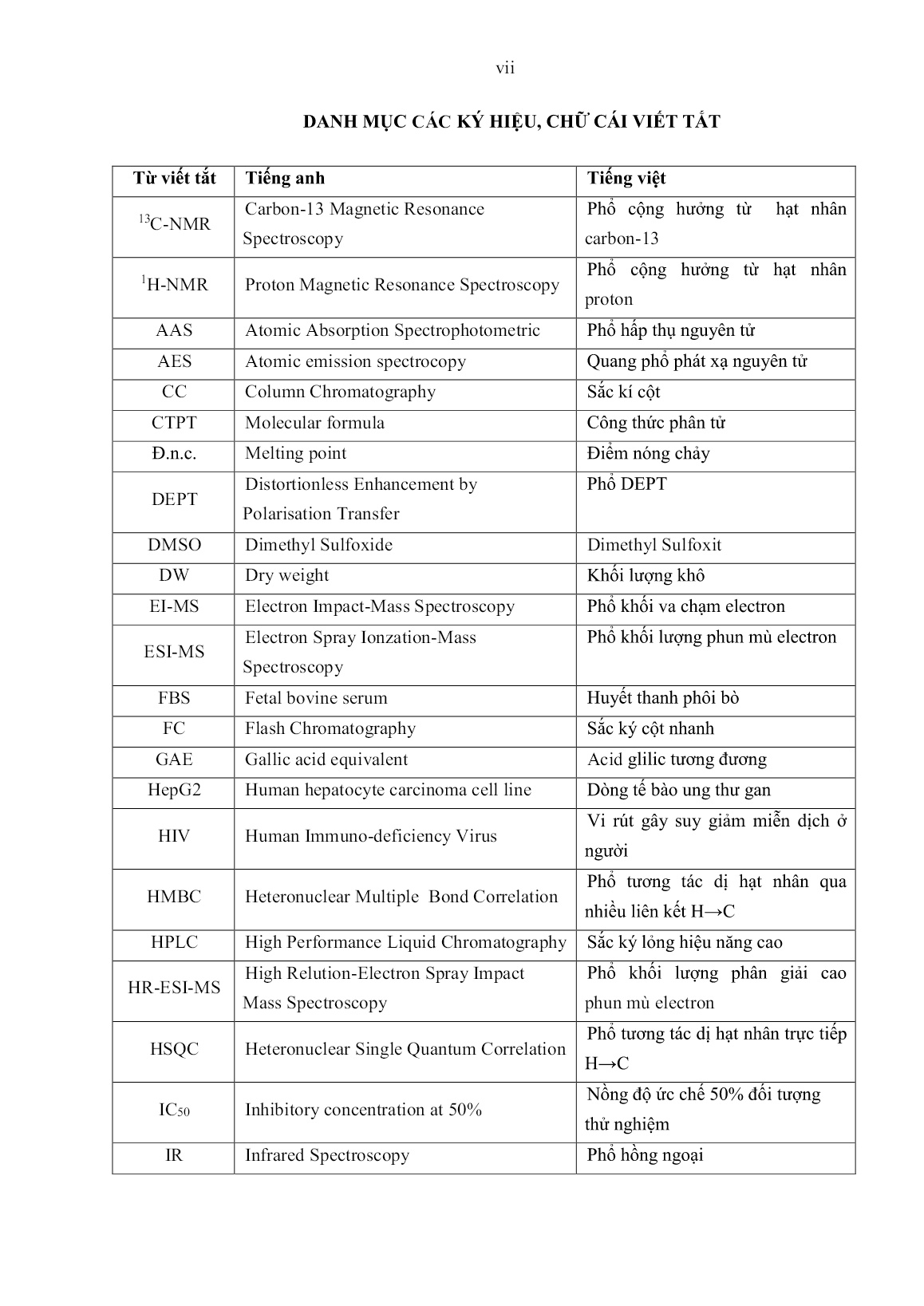
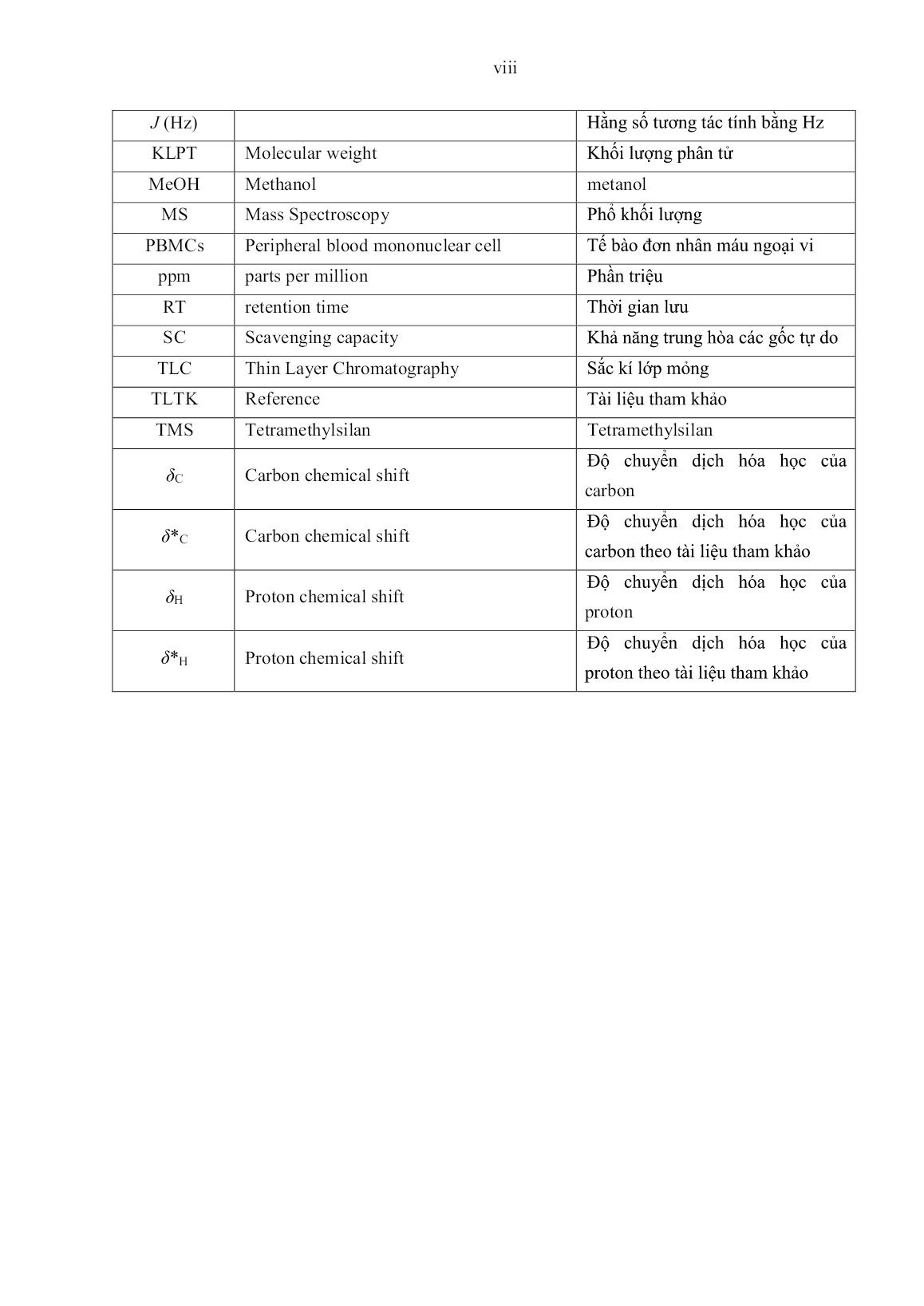
ư phân lập các hợp chất, sẽ sử dụng các phương pháp sắc ký như: sắc ký lớp mỏng (TLC); sắc ký cột thường (CC); sắc ký cột nhanh (FC); sắc ký lỏng hiệu năng cao (HPLC); phương pháp kết tinh. 2.2.2.1. Phương pháp sắc ký lớp mỏng (TLC) Sắc ký lớp mỏng phân tích được thực hiện trên bản mỏng tráng sẵn DC-Alufolien 60 F254 (Merck 105715), độ dày 0,2 mm; RP18 F254s (Merck). Phát hiện chất bằng đèn tử ngoại ở hai bước sóng 254 nm và 368 nm; dùng hơi Iot (I2) hiện màu những chất có trên bản mỏng hoặc dùng dung dịch acid sunfuric đặc (H2SO4) phun lên bản mỏng rồi hơ nóng trên bếp điện từ đến khi hiện màu. 2.2.2.2. Sắc ký cột (CC) Sắc ký cột được thực hiện với chất hấp thụ silica gel pha thường, pha đảo có cỡ hạt 70-230 mesh; 230-400 mesh (Merck). 2.2.2.3. Sắc ký lỏng hiệu năng cao (HPLC-High Perfomance Liquid Chromatography) Sắc ký lỏng hiệu năng cao được tiến hành trên hệ thống Agilent 1100 với đầu dò UV-VIS, tại trường Đại học Vinh. 2.2.3.4. Phân lập các hợp chất Mẫu nấm thượng hoàng (P. igniarius) (4,5kg) sấy khô ở nhiệt độ từ 40-50oC trong 48 giờ, nghiền nhỏ và ngâm chiết với methanol (10L x 3) ở nhiệt độ phòng, thu dịch chiết và cất thu hồi dung môi dưới áp suất thấp được cao methanol (154g). Phân bố dịch chiết vào nước (1L) và chiết bằng ethyl acetate (1L x 5) và butanol (1Lx5), sau đó cất thu hồi dung môi thu được cao ethyl acetate (42g), cao butanol (67g) và dịch nước. Cao ethyl acetate được phân tách trên cột silicagel, với hệ dung môi rửa giải là chloroform: methanol (100:0, 40:1: 30:1; 20:1; 10:1: 4:1; 2:1), thu được 5 phân đoạn (PI.E1 đến PI.E5). Phân đoạn 3 (PI.E3) phân tách lại bằng sắc ký cột với hệ dung môi rửa giải là chloroform: methanol (30:1; 20:1; 10:1), thu được 3 phân đoạn (PI.E3.1 đến PI.E3.3). Phân đoạn PI.E3.1 tiếp tục phân tách bằng sắc ký cột với hệ dung môi chloroform: methanol (30:1) thu được chất hợp chất mới PIE-1 (igniarine) (38mg) và hợp chất PIE-3 (meshimakobnol B) (23mg). Phân đoạn PI.E3.2 phân tách bằng sắc ký cột với 47 hệ dung môi chloroform: methanol (30:1) thu được chất hợp chất PIE-6 (inoscavin A) (18mg) và hợp chất PIE-7 (daidzin) (21,5mg). Phân đoạn PI.E1 sắc ký cột với silica gel hệ dung môi rửa giải hexane: axeton (15:1 và 9:1) thu được chất PIE-4 (ergosterol) (123mg). Phân đoạn PI.E4 được tiến hành sắc ký cột với hexane: axeton (15:1, 9:1) thu được hợp chất PIE-8 (pterocarpin) (18mg) và PIE-5 (ergosterol peroxit) (31mg). Phân đoạn PI.E5 được tiến hành sắc ký cột (200g, 60 × 3 cm) với chloroform/methanol (10:1) và kết tinh phân đoạn thu được hợp chất PIE-2 (meshimakobnol A) (30mg) và PIE-9 (5- hydroxy-7-methoxyflavone) (27mg). 47 Sơ đồ 2.2. Sơ đồ phân lập các hợp chất từ nấm thượng hoàng (P. igniarius) CC, Silicagel Chloroform: Methanol (100:0, 40:1: 30:1; 20:1; 10:1: 4:1; 2:1) hexan: axeton (15:1, 9:1) hexan: axeton (15:1, 9:1) Chloroform: Methanol (30:1; 20:1; 10:1) C:M (30:1) C:M (30:1) C:M (10:1) Chiết lần lượt với ethyl acetate , butanol Ngâm chiết với Methanol (10Lx3) PI.E3.3 PI.E3.1 PI.E3.2 PIE-6 (18mg) PIE-7 (21,5mg ) PIE-5 (31mg) PIE-8 (38mg) PIE-2 (30mg) PIE-9 (27mg) PI.E2 PI.E3 PI.E4 PI.E5 PI.E1 PIE-4 (123mg ) Quả thể nấm thượng hoàng (4,5kg) (Phellinus igniarius) Cao Methanol Cao ethyl acetate (42g) Cao butanol (67g) PIE-3 (23mg) PIE-1 (38mg) 48 2.2.3. Phương pháp khảo sát cấu trúc các hợp chất Cấu trúc các hợp chất được khảo sát nhờ sự kết hợp các phương pháp phổ: phổ tử ngoại (UV); phổ hồng ngoại (IR); phổ khối lượng (EI-MS), (ESI-MS), (HR-ESI-MS); phổ cộng hưởng từ hạt nhân 1H-NMR; phổ cộng hưởng từ hạt nhân 13C-NMR; phổ cộng hưởng từ hạt nhân DEPT, HMBC, HSQC; cấu trúc lập thể của các hợp chất này được xác định các phương pháp phổ NMR. 2.2.3.1. Phổ tử ngoại (UV) Phổ tử ngoại được ghi trên máy Agilent UV-Vis tại khoa Hóa học, Trường Đại học Vinh, Nghệ An. 2.2.3.2. Phổ khối lượng Hệ thống khối phổ MS/MS phân giải cao micrOTOF-QII Bruker Daltonic (Germany) đo tại Đại học khoa học tự nhiên, Đại học Quốc gia thành phố HCM. 2.2.3.3. Phổ cộng hưởng từ hạt nhân (NMR) Phổ cộng hưởng từ hạt nhân 1H-NMR đo trên máy Bruker 500MHz, phổ 13C-NMR, DEPT, HMBC, HSQC, COSY đo trên máy Bruker 125 MHz (Viện Hóa học, Viện Hàn lâm Khoa học và Công nghệ Việt Nam) và máy Bruker AVANCE III-500, (Đại học Quốc gia Cheng Kung, Đài Loan) với chất chuẩn là TMS. 2.2.3.4. Dữ kiện vật lý của các hợp chất - Hợp chất PIE-1 (igniarine): chất bột trắng vô định hình, nhiệt độ nóng chảy 205- 206ᵒC; HR-ESI-MS m/z: 453,0446 [M+Na]+; UV (MeOH) λmax: 257nm, 414nm; IR(KBr) νmax(cm-1):1690, 3400; 1H và 13C-NMR: bảng 3.13. - Hợp chất PIE-2 (meshimakobnol A): chất bột màu vàng, nhiệt độ nóng chảy 181- 182ᵒC; HR-ESI-MS m/z: 403,3346 [M+H]+; UV (MeOH) λmax: 290nm, 258nm; IR(KBr) νmax(cm-1):1706, 3542; 1H và 13C-NMR: bảng 3.14. - Hợp chất PIE-3 (meshimakobnol B): chất bột màu vàng, nhiệt độ nóng chảy 175- 176ᵒC; HR-ESI-MS m/z: 387,0485 [M+H]+; UV (MeOH) λmax: 409nm, 250nm; IR(KBr) νmax(cm-1):1685, 3369; 1H và 13C-NMR: bảng 3.14. - Hợp chất PIE-4 (ergosterol): chất bột màu trắng, nhiệt độ nóng chảy 165-167ᵒC; EI-MS m/z: 369 [M]+; UV (MeOH) λmax: 211nm, 285nm; IR(KBr) νmax(cm-1): 3433, 2959, 1726, 1090; 1H và 13C-NMR: bảng 3.15. - Hợp chất PIE-5 (ergosterol peroxit): dạng thể hình kim không màu, nhiệt độ nóng chảy 176-178ᵒC; EI-MS m/z: 428 [M]+; 1H và 13C-NMR (CDCl3) (δ ppm): bảng 3.16. - Hợp chất PIE-6 (inoscavin A): chất bột màu vàng, nhiệt độ nóng chảy 268-269ᵒC; HR-ESI-MS m/z: 463,1045 [M+H]+; 1H-NMR (500 MHz, DMSO –d6) và 13C-NMR (125 MHz, DMSO –d6) (δ ppm): bảng 3.17. - Hợp chất PIE-7 (daidzin): chất bột màu vàng nâu, nhiệt độ nóng chảy 246-247ᵒC; EI-MS m/z: 416 [M]+; 1H-NMR (500 MHz, DMSO –d6) và 13C-NMR (125 MHz, DMSO – d6) (δ ppm): bảng 3.18. 49 - Hợp chất PIE-8 (pterocarpin): Tinh thể màu trắng, có điểm nóng chảy ở 154,5- 156ᵒC; 1H-NMR (500 MHz, CDCl3-d6) và 13C-NMR (125 MHz, CDCl3-d6) (ppm): bảng 3.19. - Hợp chất PIE-9 (5-hydroxy-7-methoxyflavone): Chất rắn màu vàng, có điểm nóng chảy: 195o-196oC; UV (MeOH) max: 216, 278 và 322; ESI-MS m/z: 331 [M+H]+; 1H-NMR (500 MHz, CDCl3-d6) và 13C-NMR (125 MHz, CDCl3-d6) (ppm): bảng 3.20. 2.2.4. Các phương pháp xác định hoạt tính sinh học 2.2.4.1. Xác định hoạt tính chống oxy hóa Xác định hoạt tính chống oxy hóa bằng phương pháp DPPH (1,1-diphenyl-2- picrylhydrazyl) [25], [119]. Chất thử được hòa trong dimethyl sulfoxide (DMSO 100%) và DPPH được pha trong ethanol 96%. Sự hấp thụ của DPPH ở bước sóng λ = 515nm được xác định bằng máy đọc ELISA sau khi nhỏ DPPH vào dung dịch mẫu thử trên phiên vi lượng 96 giếng. Kết quả các thử nghiệm được thể hiện là giá trị trung bình của ít nhất 3 phép thử lặp lại ± độ lệch chuẩn (p ≤ 0,05). Khả năng trung hòa các gốc tự do (Scavenging capacity, SC%): Giá trị trung bình của SC (%) ở các nồng độ mẫu được đưa vào chương trình xử lý số liệu Excel theo công thức: 𝑆𝐶% = [100 − OD(mẫu thử) − OD(mẫu trắng) OD (chứng âm tính) x100] ± σ Độ lệch tiêu chuẩn tính theo công thức của Ducan như sau: 𝜎 = √ (∑ 𝑥𝑖 − 𝑥) 2 𝑛 − 1 Giá trị SC50 (µg/ml) được pha loãng thành các nồng độ giảm dần, lặp lại 3 lần ở mỗi nồng độ. Hiệu quả bẫy gốc tự do tạo ra bởi DPPH của mỗi mấu được tính dựa trên % trung hòa gốc tự do so với mẫu trắng (Blank) và chứng âm tính. Mẫu có biểu hiện hoạt tính chống oxy hóa trên hệ DPPH được thực hiện các bước tiếp theo để tìm giá trị SC50 (µg/ml). Giá trị SC50 là nồng độ của chất thử mà tại đó trung hòa được 50% các gốc tự do, được xác định bằng phần mềm TableCurve AISN Sofware (Jandel Scientific) qua giá trị SC% và dãy các nồng độ chất thử tương ứng. 2.2.4.2. Phương pháp thử hoạt tính kháng các dòng tế bào ung thư Các hợp chất được phân lập từ quả thể nấm Phellinus igniarius gây độc tế bào trên các dòng tế bào ung thư HepG2, MCF7, Lu ở Phòng Sinh học thực nghiệm, Viện Hoá học các hợp chất thiên nhiên, Viện Hàn lâm Khoa học và Công nghệ Việt Nam. Các mẫu được thử khả năng kháng tế bào ung thư gan HepG2, ung thư phổi Lu và ung thư vú MCF-7 theo phương pháp của Lee và cộng sự [80]. Tế bào được nuôi cấy trong môi trường RPMI 1640 có bổ sung thêm 10% huyết thanh phôi bò (FBS) và 2% penicillin-streptomycin (GIBCO), ủ vô trùng ở 37ᵒC trong điều kiện 5% CO2 và thu sinh khối ở pha lỏng. Tế bào được chia vào đĩa 96 lỗ trong môi trường RPMI 1640 (1.104 tế bào/giếng). Mẫu thử nghiệm đã được 50 hòa tan trong DMSO và được điều chỉnh đến nồng độ mẫu cuối cùng dao động từ 5 đến 100 μg/mL bằng cách pha loãng với môi trường tăng trưởng, mỗi mẫu chuẩn bị 3 lần. Nồng độ DMSO cuối cùng đã được điều chỉnh xuống <0,1%. Sau 24h, mẫu thử được thêm vào mỗi giếng, cùng thể tích môi trường với 0,1% DMSO thêm vào để kiểm soát các tế bào. Sau 48h thì bổ sung mẫu thử. Thuốc thử MTT (3-(4,5-dimethylthiazol-2-yl)-2,5- diphenyltetrazolium) được thêm vào mỗi giếng (nồng độ cuối là 5μg/mL). Sau 4h, cho vào đĩa và ly tâm ở 1500 vòng/phút trong 5 phút, loại bỏ môi trường, cặn hòa tan trong DMSO. Tiến hành đo ở bước sóng 570nm, sử dụng đầu đọc Titertek microplate (Multiskan MCC/340, Flow). Hoạt tính gây độc tế bào được giải thích theo giá trị IC50 2.2.5. Quy hoạch thực nghiệm Bố trí thí nghiệm được thực hiện theo quy hoạch bậc hai Box-Behnken [1], [8], [30]; với k =3 có 15 thí nghiệm (12 thí nghiệm tại 3 mức (-1, 0, +1) và 3 thí nghiệm tại tâm (0, 0, 0)) hoặc 17 thí nghiệm (12 thí nghiệm tại 3 mức (-1, 0, +1) và 5 thí nghiệm tại tâm (0, 0, 0)). Số thực nghiệm theo quy hoạch Box-Behnken được tính theo công thức: 𝑁 = 22. 𝐶𝑘 2 + 𝑛0 với k là số yếu tố ảnh hưởng. Bảng 2.4. Bố trí thí nghiệm nghiên cứu TT Các giá trị X1 X2 X3 1 0 0 0 2 - - 0 3 - 0 + 4 0 + - 5 0 0 0 6 0 - + 7 0 + + 8 - + 0 9 - 0 - 10 + + 0 11 + - 0 12 + 0 - 13 0 - - 14 + 0 + 15 0 0 0 Các bước tiến hành thực hiện như sau: + Lựa chọn các thông số ảnh hưởng và khoảng biến thiên của các yếu tố đó. + Xây dựng ma trận thực nghiệm và tiến hành thí nghiệm theo ma trận. + Tìm hệ số hồi quy. + Kiểm định sự có nghĩa của hệ số hồi quy. 51 + Kiểm định sự tương thích của mô hình đã chọn. + Tối ưu hóa chập mục tiêu Phương pháp tối ưu hóa hàm đa mục tiêu (phương pháp hàm mong đợi theo Harrington 1965) + Tối ưu hóa hàm mục tiêu đã chọn bằng phương pháp hàm mong đợi (Harrington 1965), phương pháp này gồm ba bước thực hiện: - Thiết lập hàm mục tiêu: Yi = fi(X1, X2,..., Xk). - Chuyển đổi hàm mục tiêu thành hàm d: di = Ti(Yi) - Thiết lập hàm mong đợi: D = g(d1, d2,...,dm) Harrington (1965) đã đưa ra phương thức tối ưu hóa đa mục tiêu bằng việc xây dựng hàm mong đợi, sau đó Gatza-Millan (1972), sau đó Derringer và Suich (1980) đã cải tiến việc tính toán hàm mong đợi và được sử dụng trong phần mền Design Expert [30], [31]. Hàm mong đợi D được tính như sau: D = √d1 m d2 dm Trong trường hợp các hàm mục tiêu di có tầm quan trọng hay thứ bậc khác nhau, thì hàm D được tính như sau, có tính đến thứ bậc quan trọng (wi) của các mục tiêu: D = √d1 Wim d2 Wi dm Wm W = ∑ 𝑤𝑖 𝑚 1 Các hàm di được tính như sau: di = exp [- exp (Yi)] Khoảng chấp nhận một phía (phía trái hoặc phải) di = exp (- Yi) Khoảng chấp nhận 2 phía 2.2.6. Phương pháp tiến hành quá trình chiết xuất dịch nấm thượng hoàng Trong nghiên cứu này, các thí nghiệm về khảo sát và tối ưu hóa quá trình tách chiết một số hoạt chất có hoạt tính sinh học trong hai loài nấm thượng hoàng (P. igniarius và P. nilgheriensis) được chúng tôi tiến hành như sau: Cân chính xác 10g mẫu nguyên liệu, đã được xay nhỏ kích thước 1x1mm, cho vào thiết bị chiết xuất (thiết bị gia nhiệt 2 vỏ có thể tích 500ml). Dùng ống đong chính xác 30ml dung môi (dung môi được pha theo đúng nồng độ yêu cầu ở nhiệt độ phòng là 25oC) cho vào thiết bị, đặt điều kiện công nghệ theo yêu cầu và tiến hành chiết xuất. Mẫu sau khi chiết được lọc để bỏ bã, thu được dịch chiết cuối và mang đi xác định hàm lượng tổng phenolic (theo mục 2.2.1.5), tổng hàm lượng flavonoid (theo mục 2.2.1.6) và hàm lượng chất khô thu hồi Thiết bị sử dụng: Thiết bị gia nhiệt hai vỏ Reactor-ready, hãng Lauda. Dải nhiệt độ điều chỉnh được từ 2-98oC. Tốc độ cánh khuấy 25-30 vòng/phút. 2.2.7. Phương pháp tiến hành quá trình sấy phun dịch chiết từ nấm thượng hoàng Tiến hành quá trình chiết xuất với các điều kiện thông số tối ưu nhằm tạo được dịch chiết chứa tối đa hàm lượng một số hợp chất mong muốn. Mẫu dịch chiết được tiến hành cô thu hồi dung môi, để nồng độ chất khô trong dịch tăng lên đến 20-25%. Mẫu sau khi cô 52 được bổ sung chất trợ sấy theo các tỷ lệ khác nhau rồi sau đó tiến hành quá trình sấy phun dịch chiết. Sản phẩm bột sấy phun được mang đi xác định hàm lượng tổng phenolic (theo mục 2.2.1.5 và đã trừ đi hàm lượng matodextrin bổ sung) và độ ẩm sản phẩm, bột còn lại được bảo quản ở 3-4oC để thực hiện các nghiên cứu tiếp theo. 2.2.6. Đánh giá cảm quan cho theo phương pháp cho điểm thị hiếu Đánh giá cảm quan chất lượng sản phẩm theo phương pháp cho điểm thị hiếu, được thực hiện với Hội đồng gồm 30 người cho mỗi lần thử. Những người này có độ tuổi khác nhau từ 18-35 tuổi, cả nam và nữ để nhằm tìm ra sự hài lòng và ưa thích về mùi, vị của sản phẩm Mẫu phân tích gồm: Sản phẩm trà hòa tan bổ sung nấm thượng hoàng, Sản phẩm cà phê hòa tan bổ sung nấm thượng hoàng, Sản phẩm bánh quy bổ sung bột nấm thượng hoàng. Địa điểm thực hiện: Các sản phẩm được đánh giá tại Phòng thí nghiệm Phân tích chất lượng thực phẩm, Trung tâm Thực hành – Thí nghiệm, Đại học Vinh. Tiến hành phân tích: Sản phẩm trà hòa tan bổ sung nấm thượng hoàng, Các sản phẩm bổ sung bột nấm thượng hoàng được yêu cầu sắp xếp theo các mẫu thứ tự ưa thích về mùi, vị và đồng thời cho điểm vào phiếu phân tích. 2.2.7. Phương pháp thống kê xử lý số liệu - Trong thí nghiệm chiết tách, sấy phun dịch chiết, các thí nghiệm được bố trí theo quy hoạch thực nghiệm trực giao cấp 2 và được xử lý bằng phần mềm tối ưu hóa Design - Expert phiên bản 7.1 [31] - Trong thí nghiệm phân tích thị hiếu, đánh giá cảm quan chất lượng sản phẩm bổ sung bột nấm thượng hoàng sử dụng phần mềm thống kê SPSS phiên bản 18 [1], [105] 53 Chương 3 KẾT QUẢ VÀ THẢO LUẬN 3.1. KẾT QUẢ NGHIÊN CỨU THÀNH PHẦN DINH DƯỠNG VÀ THÀNH PHẦN HÓA HỌC CỦA NẤM THƯỢNG HOÀNG 3.1.1. Hàm lượng cellulose trong nguyên liệu Hàm lượng cellulose trong nấm thượng hoàng (P. igniarius và P. nilgheriensis) được xác định theo nguyên tắc hòa tan bằng acid và kiềm. Bảng 3.1. Hàm lượng cellulose trong nấm thượng hoàng Mẫu Hàm lượng cellulose (%) P. igniarius 26,5 ± 0,6 % P. nilgheriensis 38,4 ± 0,9 % Hàm lượng cellulose trong hai loài nấm thượng hoàng P. igniarius (26,5±0,6%) và P. nilgheriensis (38,4 ± 0,9%) thu hái tự nhiên khu vực Bắc trung bộ có giá trị tương đối thấp hơn so với hàm lượng cellulose của mẫu nấm linh chi (G. lucidum) trong nghiên cứu của Nguyễn Thị Minh Tú (54,42%) [11]. 3.1.2. Hàm lượng acid amin Tiến hành phân tích hàm lượng acid amin trong một số mẫu nấm thượng hoàng (nguyên liệu ban đầu và bột sấy sau khi chiết xuất) trên thiết bị HPLC tại Trung tâm Phân tích và An toàn thực phẩm, Trường Đại học Vinh. Ký hiệu các mẫu nấm mang đi xác định hàm lượng acid amin theo bảng sau. Bảng 3.2. Hàm lượng acid amin trong nấm thượng hoàng (P. igniarius và P. nilgheriensis) TT Acid amin P. igniarius (PI.A1) (µg/g nguyên liệu) P. nilgheriensis (PN.A1) (µg/g nguyên liệu) 1 Threonine 7,32 23,02 2 Valine KPH 527,47 3 Methionine 51,90 88,31 4 Isoleucine 108,66 37,39 5 Leucine 537,61 419,96 6 Phenylalanine 747,98 741,48 7 Lysine 207,77 289,27 8 Histidine 1037,40 1048,46 Tổng acid amin thiết yếu (EAA) 2698,64 3175,40 9 Aspartic 882,97 1351,15 10 Glutamic KPH KPH 54 11 Serine 0 326,85 12 Glycine KPH 220,58 13 Cysteine 1890,87 454,07 14 Alanine 270,37 469,01 15 Arginine KPH KPH 16 Tyrosine 83,64 52,76 17 Proline 556,47 472,21 Tổng acid amin không thiết yếu 3774,32 3346,65 Tổng acid amin (TAA) 6472,96 6522,06 EAA/TAA 41,69% 48,68% KPH-Không phát hiện Kết quả nghiên cứu cho thấy, đối với mẫu nguyên liệu nấm P. igniarius, bốn loại acid amin không phát hiện thấy là valine, aspartic, glyciene và arginine. Các acid amin có hàm lượng cao đó là cysteine (1890,87µg/g), histidine (1037,40µg/g), aspartic (882,97µg/g) và phenylalanine (747,98µg/g). Đối với loài P. nilgheriensis thì hàm lượng aspartic cao nhất (1351,15µg/g), histidine (1048,46µg/g), hai loại acid amin không phát hiện thấy trong loài nấm này là glutamic và arginine. Trong hai loài nấm này, hàm lượng histidine đều có giá trị cao, đây là tiền chất của histamine và carnosine, tham gia vào hoạt động của hệ miễn dịch và thần kinh. So sánh với hàm lượng acid amin của loài P. linteus ở Hàn Quốc trong nghiên cứu của Lee J. K. và cộng sự (2010) [88] thì hàm lượng amino axids của nấm thượng hoàng ở Việt Nam có hàm lượng thấp hơn. So sánh với mẫu nấm Linh chi (Ganoderma lucidum) cũng thu hái tại khu vực này và cùng phân tích trên một thiết bị, phương pháp giống nhau thì kết quả thu được là hàm lượng tổng acid amin (TAA) của loài nấm Linh chi cao hơn nhiều (26338,8µg/g) so với nấm thượng hoàng loài P. igniarius (6472,96µg/g) và loài P. nilgheriensis (6522,06µg/g). Bảng 3.3. Hàm lượng acid amin trong mẫu nấm P. igniarius theo các phương pháp sấy khác nhau TT Acid amin Mẫu sau khi chiết và sấy đông khô (PI.A2) (µg/g bột cao chiết sấy khô) Mẫu sau khi chiết và sấy chân không (PI.A3) (µg/g bột cao chiết sấy khô) 1 Threonine 0 KPH 2 Valine 2582,3 2019,58 3 Methionine 418,02 369,65 4 Isoleucine 286,23 232,34 5 Leucine 3120,5 2318,08 55 6 Phenylalanine 2987,1 2389,19 7 Lysine 1019,0 861,04 8 Histidine 3407,9 2587,22 Tổng acid amin thiết yếu (EAA) 13893,1 10777,1 9 Aspartic 2818,5 2285,56 10 Glutamic KPH KPH 11 Serine KPH KPH 12 Glycine KPH KPH 13 Cysteine 5943,4 4531,36 14 Alanine 0 0 15 Arginine KPH KPH 16 Tyrosine 921,29 364,36 17 Proline 4633,5 5020,9 Tổng acid amin không thiết yếu 14316,7 12202,18 Tổng acid amin (TAA) 28209,8 22979,28 EAA/TAA 49,25% 46,90% 3.1.3. Hàm lượng các loại vitamin trong nấm thượng hoàng 3.1.3.1. Hàm lượng vitamin E Tiến hành xác định hàm lượng vitamin E trên thiết bị sắc ký lỏng hiệu năng cao (HPLC) đối với hai mẫu nấm P. igniarius và P. nilgheriensis cho kết quả như bảng sau: Bảng 3.4. Hàm lượng vitamin E trong nấm thượng hoàng (P. igniarius và P. nilgheriensis) Mẫu Ký hiệu mẫu Hàm lượng vitamin E (µg/g) P. igniarius PL3 0,00492 P. nilgheriensis PL4 0,00267 Kết quả phân tích cho thấy, hàm lượng vitamin E trong loài P. igniarius (0,00492µg/g) cao hơn so với loài P. nilgheriensis (0,00267µg/g). Hàm lượng vitamin E trong 2 loài nấm thượng hoàng thu hái tại Việt Nam thấp hơn so với loài Boletus edulis (0,0089÷0,045µg/g) [141]. 3.1.3.2. Hàm lượng vitamin D2 Xác định hàm lượng vitamin D2 trong nguyên liệu nấm P. igniarius, P. nilgheriensis và bột sau khi chiết mang đi sấy đông khô của hai nấm này, thu được kết quả như sau: 56 Bảng 3.5. Hàm lượng vitamin 𝑫𝟐 trong nguyên liệu nấm thượng hoàng Mẫu nguyên liệu Hàm lượng vitamin D2 (µg/g nguyên liệu) P. igniarius - P. nilgheriensis 0,0004 Bảng 3.6. Hàm lượng vitamin 𝑫𝟐 trong bột nấm thượng hoàng sau khi sấy đông khô Mẫu bột sấy đông khô Hàm lượng vitamin D2 (µg/g bột cao chiết) P. igniarius 0,09737 P. nilgheriensis 0,25675 Trong 4 mẫu nghiên cứu thì mẫu nguyên liệu nấm P. igniarius (M1) hầu như không thể hiện hàm lượng vitamin D2, hàm lượng vitamin D2 trong loài P. nilgheriensis có giá trị 0,0004µg/g (0,04µg/100g) nguyên liệu. Đối với 2 mẫu nấm sau khi chiết xuất và sấy đông khô thì hàm lượng vitamin D2 trong bột nấm P. nilgheriensis (0,2567
File đính kèm:
 luan_an_nghien_cuu_cong_nghe_thu_nhan_mot_so_hop_chat_co_hoa.pdf
luan_an_nghien_cuu_cong_nghe_thu_nhan_mot_so_hop_chat_co_hoa.pdf 2.TTLA_Nguyen_Tan_Thanh.pdf
2.TTLA_Nguyen_Tan_Thanh.pdf 3.THÔNG TIN MỚI_Nguyen_Tan_Thanh.pdf
3.THÔNG TIN MỚI_Nguyen_Tan_Thanh.pdf

