Luận án Nghiên cứu thu nhận một số nhóm hợp chất có hoạt tính từ vỏ quả măng cụt (garcinia mangostana linn) và định hướng ứng dụng trong công nghiệp thực phẩm

Trang 1

Trang 2

Trang 3

Trang 4

Trang 5

Trang 6

Trang 7

Trang 8

Trang 9
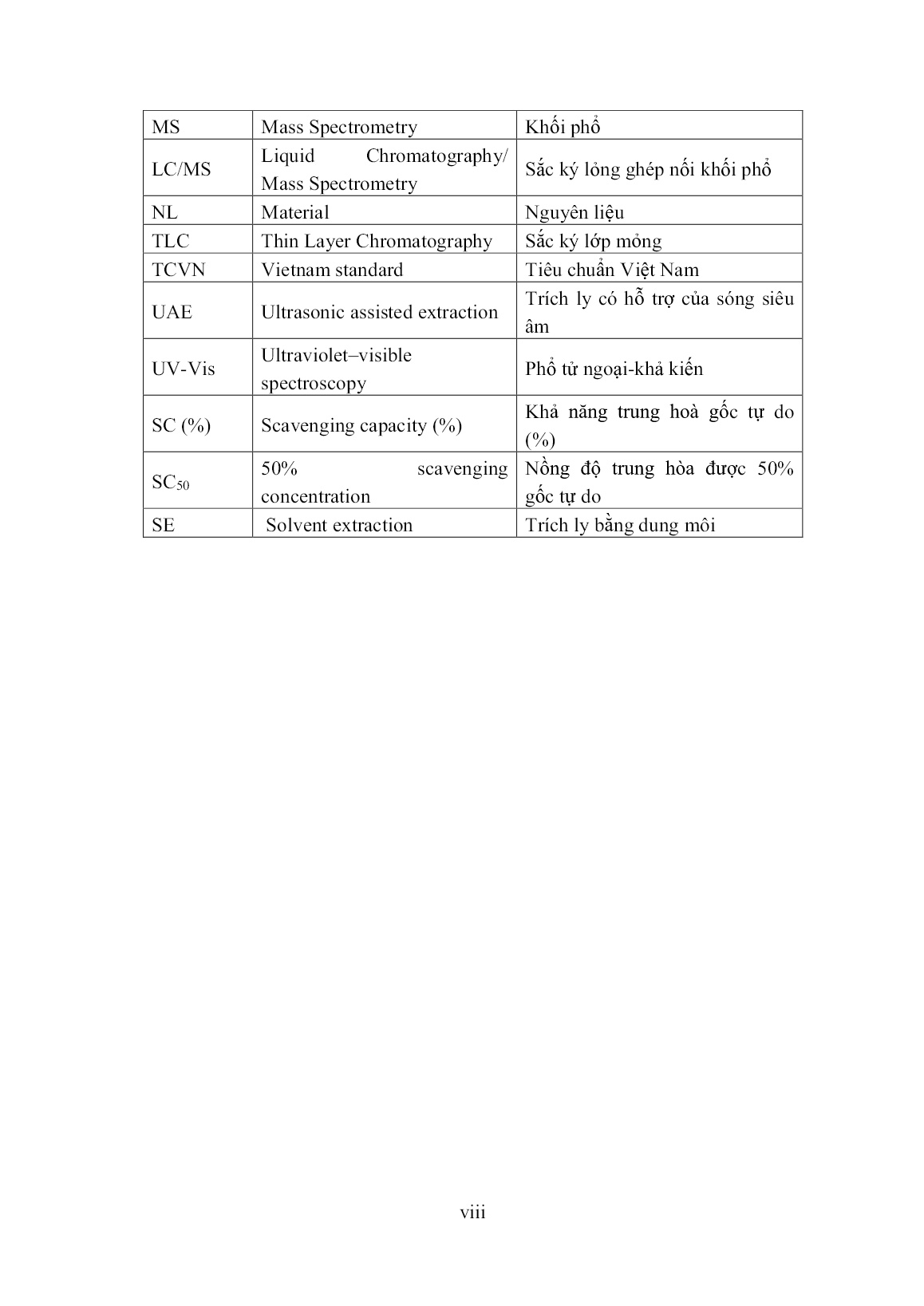
Trang 10
Tải về để xem bản đầy đủ
Bạn đang xem 10 trang mẫu của tài liệu "Luận án Nghiên cứu thu nhận một số nhóm hợp chất có hoạt tính từ vỏ quả măng cụt (garcinia mangostana linn) và định hướng ứng dụng trong công nghiệp thực phẩm", để tải tài liệu gốc về máy hãy click vào nút Download ở trên.
Tóm tắt nội dung tài liệu: Luận án Nghiên cứu thu nhận một số nhóm hợp chất có hoạt tính từ vỏ quả măng cụt (garcinia mangostana linn) và định hướng ứng dụng trong công nghiệp thực phẩm

tuyệt đối với các dung dịch mô phỏng dịch vị ở các cơ quan tiêu hoá điển hình trong cơ thể người theo tỷ lệ 1:1. Các dung dịch mô phỏng dịch vị bao gồm: Dung dịch pH 1,2: tương ứng với phần dưới dạ dày (nơi chất được lưu lại từ 1 đến 3 giờ); dung dịch pH 4,5: tương ứng với phần trên của dạ dày (nơi chất được lưu lại từ 30 đến 60 phút), tương ứng với ruột non (nơi chất ở lại từ 1 đến 5 giờ) và ruột già (nơi chất ở lại 10 giờ); dung dịch pH 6,8: tương ứng với vùng đại tràng trong cơ thể (nơi chất được lưu lại từ 10 đến 15 giờ) và dung dịch pH 7,4: tương ứng với vùng tá tràng trong cơ thể (nơi chất được lưu lại từ 30 đến 60 phút) Chuẩn bị dãy chuẩn: Cân 0,01g α-mangostin cho vào cốc chứa 200mL dung dịch đệm và khuấy từ liên tục trong 8 giờ với tốc độ 400 vòng/phút. Sau 8 giờ, lọc bỏ phần không tan và pha loãng thành dãy chuẩn có nồng độ giảm dần. Ghi phổ UV-Vis của dãy chuẩn trên thiết bị phổ UV-Vis Libra S80 (hãng Biochrom, Hoa Kỳ) tại Viện Kỹ thuật nhiệt đới - Viện Hàn lâm Khoa học và Công nghệ Việt Nam ở dải bước sóng từ 220 đến 400nm. Từ dữ liệu phổ xác định bước sóng cực đại (λmax) và độ hấp thụ ánh sáng của α-mangostin trong các dung dịch 58 ethanol 99,7% và các dung dịch pH 1,2, pH 4,5, pH 6,8, pH 7,4 có chứa 50% ethanol ở λmax. Xử lý số liệu thu được bằng phần mềm excel để dựng đường chuẩn mô phỏng sự phụ thuộc mật độ quang và nồng độ của α-mangostin trong các dung dịch thử nghiệm. Viết phương trình hồi quy tuyến tính của đường chuẩn y = ax + b và hệ số hồi quy tuyến tính (R2). - Xác định hàm lượng α-mangostin từ các hạt tổ hợp CCG: Để nghiên cứu quá trình giải phóng α-mangostin từ các hạt tổ hợp: cân 0,01g hạt tổ hợp CCG cho vào cốc 250mL có chứa 200mL dung dịch đệm có pH khác nhau. Đặt cốc lên máy khuấy từ và khuấy với tốc độ 400 vòng/phút ở 37oC trong suốt thời gian theo dõi. Trong một giờ đầu, cứ 20 phút một lần và các giờ tiếp theo thì cứ sau 1 giờ, hút chính xác 5mL dịch trong và bổ sung thêm 5mL dung dịch đệm. Sau đó đo mật độ quang dịch mẫu đã lấy trên thiết bị UV-Vis ở bước sóng cực đại. Lượng α-mangostin giải phóng được tính toán dựa trên phương trình đường chuẩn và giá trị mật độ quang đo được. Phần trăm α-mangostin giải phóng được tính theo công thức: % α-mangostin giải phóng= Ct C0 ×100 (%) (2.17) Trong đó: C0 và Ct tương ứng là lượng α-mangostin có trong hạt CCG ban đầu và lượng α-mangostin giải phóng tại thời gian t. - Xây dựng phương trình động học giải phóng α-mangostin từ các hạt tổ hợp trong các dung dịch đệm có pH khác nhau: Có nhiều mô hình động học liên quan đến quá trình giải phóng hoạt chất được mang bởi các polyme hoặc hỗn hợp polyme. Cơ chế giải phóng hoạt chất không chỉ phụ thuộc vào liều lượng hoạt chất, pH của môi trường mà còn phụ thuộc vào bản chất của hoạt chất và polyme. Các mô hình động học giải phóng hoạt chất được áp dụng phổ biến nhất là: (1) Phương trình mô hình động học bậc không: 𝑥𝑡 = xo + k1 × t (2.18) (2) Phương trình mô hình động học bậc 1: log xt = log 𝑥o − k2 × t/2,303 (2.19) (3) Phương trình mô hình động học Hixon- Crowell: 𝑥0 1 3⁄ − 𝑥𝑡 1 3⁄ = 𝑘3 × 𝑡 (2.20) (4) Phương trình mô hình động học Higuchi: 𝑥𝑡 = k4 × 𝑡 1 2⁄ (2.21) 59 (5) Phương trình định luận năng lượng ((hay phương trình Korsmeyer - Peppas): xt x∞ = k5 × t n (2.22) Trong đó: t: Thời gian giải phóng chất xt và x0: là lượng chất (α-mangostin) giải phóng ở thời điểm t và thời điểm ban đầu. k1, k2, k3, k4, k5: hằng số phương trình xt x∞ : là phần chất giải phóng vào môi trường hòa tan n: là hằng số khuếch tán, đặc trưng cho cơ chế giải phóng hoạt chất theo mô hình Kosmeyer – Peppas. Khi n ≤ 0,5, sự giải phóng thuốc tuân theo định luật khuếch tán Fick. Khi n > 0,5, sự giải phóng thuốc là bất qui tắc (không tuân theo định luật khuếch tán Fick). Khi n = 1, giải phóng thuốc không tuân theo định luật Fick mà tuân theo động học bậc một hoặc động học bậc không. Sử dụng phần mềm excel để vẽ đồ thị mô phỏng quá trình giải phóng α- mangostin trong các dung dịch có pH khác nhau. 2.4.13. Đánh giá màu của giò bằng hệ thống Computer vision Hình ảnh, màu sắc của sản phẩm được xác định thông qua thị giác máy tính và xử lý hình ảnh bằng cách sử dụng hệ thống đo màu và xử lý ảnh (Computer Vision). Các mẫu giò được đo màu bằng hệ thống thiết bị Computer Vision tại Viện Cơ Điện nông nghiệp và Công nghệ sau thu hoạch. Hệ thống thiết bị có sử dụng máy ảnh Canon EOS 450d, hệ thống đo và điều khiển cường độ ánh sáng kết hợp với đèn led có nhiệt độ màu 5500k, cường độ ánh sáng 1500lux. Từ thông số màu R, G, B trung bình của nhiều điểm ảnh tính ra các chỉ số màu L, a, b. Trong đó, khoảng biến thiên màu theo các giá trị L, a, b: - L phản ánh độ đậm nhạt (hay độ sáng), L có giá trị biến đổi từ 0 (tương ứng màu đen) tới 100 (tương ứng màu trắng). - a biến đổi từ -60 (tương ứng màu xanh lục) tới 60 (tương ứng màu đỏ) - b biến đổi từ -60 (tương ứng màu xanh lam) tới 60 (tương ứng màu vàng) 2.4.14. Đánh giá màu của rượu bằng phương pháp đo quang Xác định màu sắc của sản phẩm bằng phương pháp đo quang dựa trên hiện tượng phản xạ của ánh sáng. Những nguồn sáng được truyền tới là ánh sáng trắng của các tia sáng đơn sắc (từ đỏ đến tím) có bước sóng khác nhau được chiếu lên vật liệu cần đo. Khi đó, tia sáng được phản xạ lại mắt người có màu sắc phản ánh màu sắc của vật liệu cần đo. 60 Các mẫu rượu được xác định màu bằng thiết bị quang phổ UV-Vis Libra S80 (Biochrom, Hoa Kỳ) tại Viện Kỹ thuật nhiệt đới - Viện Hàn lâm Khoa học và Công nghệ Việt Nam với dải bước sóng từ 200 ÷ 700nm. Chỉ số cường độ màu (I) và trạng thái màu (chỉ số Hue, H) được tính theo công thức (2.23) và (2.24) [152]: I = OD420 + OD520+OD620 (2.23) H = OD420 /OD520 (2.24) Giá trị H phản ánh sự phát triển màu của rượu theo độ tuổi, phát triển thiên hướng màu cam. H thường 1 khi già hơn (tối đa 1,2÷1,3) (Phát triển theo hướng màu cam). Tỷ lệ giữa các màu được đánh giá theo công thức 2.25, 2.26 và 2.27 [152]: Tỷ lệ màu vàng (Y, %): 𝑌 = 𝑂𝐷420 𝐼 × 100 (2.25) Tỷ lệ màu đỏ (R, %): 𝑅 = 𝑂𝐷520 𝐼 × 100 (2.26) Tỷ lệ màu xanh (B, %): 𝐵 = 𝑂𝐷620 𝐼 × 100 (2.27) Trong đó OD420, OD520 và OD620 là giá trị mật độ quang của mẫu rượu đo trên thiết bị quang phổ UV-Vis tại bước sóng 420, 520 và 620nm. 61 Chương 3. KẾT QUẢ VÀ BÀN LUẬN 3.1. Nghiên cứu phân tích thành phần hoá học của vỏ quả măng cụt Kết quả đánh giá một số thành phần hoá học của vỏ quả măng cụt khô thu hoạch ở 06 tỉnh trồng măng cụt phổ biến tại Việt Nam (Bao gồm: Cần Thơ, Vĩnh Long (An Bình), Trà Vinh (Cầu Kè), Bến Tre (Cái Mơn), Bình Dương (Lái Thiêu) và Lâm Đồng (Bảo Lộc)) được trình bày trong Bảng 3.1. Bảng 3.1. Kết quả phân tích một số thành phần hoá học của vỏ quả măng cụt khô thu hoạch tại các tỉnh khác nhau ở Việt Nam TT Hàm lượng Vĩnh Long (An Bình) Bình Dương (Lái Thiêu) Trà Vinh (Cầu Kè) Cần Thơ (Thành phố Cần Thơ) Bến Tre (Cái Mơn) Lâm Đồng (Bảo Lộc) 1 Nước (%) 8,94±0,35 8,65±0,43 9,43±0,09 7,85±0,21 5,70±0,95 9,33 ±0,47 2 Polyphenol tổng số (g GAE/100g) 20,12 ± 0,46 20,45 ± 0,56 23,34 ± 0,52 21,91 ± 0,04 19,29±0,05 20,28±0,10 3 Tanin (Polyphenol) (%) 13,80 ± 0,23 14,15 ± 0,11 14,50 ± 0,45 13,91 ± 0,44 11,54±2,01 14,15±0,09 4 Anthocyanin g C-3-G/100g) 0,12±0,00 0,13±0,01 0,16±0,01 0,11± 0,00 0,12±0,01 0,13±0,00 6 Cellulose (%) 41,91 ± 0,28 43,44 ± 0,53 43,34 ± 0,43 41,56 ± 0,41 41,57± 1,27 42,12±1,46 7 Tinh bột (%) 9,23 ± 0,57 8,43 ± 0,50 8,40 ± 0,30 8,86 ± 0,14 - 8,43 ± 0,50 8 Pectin (%) 2,52 ± 0,69 3,07 ± 0,86 2,82 ± 0,63 2,79 ± 0,75 - 3,08 ± 0,22 9 Tro (%) 3,68 ± 0,12 3,27 ± 0,09 3,87 ± 0,14 2,63 ± 0,10 - 3,36 ± 0,11 Số mẫu n=3; “-” không đánh giá; Polyohenol tổng số (g GAE/100g): Định lượng polyphenol theo TCVN 9745-1:2013 Tanin (polyphenol) (%): Định lượng tanin (polyphenol) theo phương pháp Lowenthal Kết quả phân tích cho thấy trong vỏ quả măng cụt khô thu hoạch vụ 2018 ở các tỉnh miền nam Việt Nam có hàm lượng polyphenol (được định lượng theo TCVN 9745-1:2013) dao động trong khoảng 19,29 ÷23,34% và tanin (polyphenol) (định lượng bằng phương pháp Lowenthal) từ 11,54÷14,50 (%), kết quả này cũng tương đương với nghiên cứu của Khanitha Moosophin (2010) (Hàm lượng tanin 11,14%) [6] và không thua kém so với một số nguyên liệu truyền thống đang được 62 sử dụng để khai thác các hợp chất polyphenol, tanin như chè (polyphenol 13,3÷26,1%, catechin 9,63÷21,54%) [153], ổi (233,76 mg GAE/g chất khô) [29]. Kết quả phân tích cho thấy vỏ quả măng cụt thu thập tại các địa phương này là nguồn khai thác tiềm năng các hợp chất polyphenol. Tuy nhiên, đánh giá các thông tin về thực trạng sản xuất và tiêu thụ măng cụt, sự tác động của biến đổi khí hậu và chính sách phát triển loại cây này tại 06 địa phương cho thấy ở 2 Lâm Đồng và Cần Thơ ngày càng tăng cả về diện tích trồng, sản lượng, chất lượng quả trong đó đặc biệt măng cụt Bảo Lộc – Lâm Đồng ngày càng khẳng định được thương hiệu trên thị trường [19, 21]. Vì vậy, với mục tiêu khai thác các hợp chất có hoạt tính sinh học nhóm polyphenol từ vỏ quả măng cụt, chúng tôi đã lựa chọn măng cụt Lâm Đồng và Cần Thơ để nghiên cứu. Ngoài các hợp chất polyphenol, hàm lượng hợp chất anthocyanin trong vỏ quả măng cụt tươi với hàm lượng tới 4235 ± 203,5g/kg quả tươi [96], không thua kém so với một số nguyên liệu giàu anthocyanin như khoai lang tím (687,58 ppm) [154] và quả việt quất tươi (7,2 ± 0,5 mg/g chất khô) [155]. Tuy nhiên, các mẫu vỏ quả măng cụt khô mà đề tài sử dụng hàm lượng mono anthocyanin thấp hơn đáng kể, hàm lượng dao động giữa các mẫu từ 0,11÷0,16 (g C-3-G/100g), chứng tỏ việc làm khô nguyên liệu đã tác động tới sự tồn tại của nhóm hợp chất này. Điều này dự báo hàm lượng các hợp chất anthocyanin trong chiết xuất thu được từ vỏ quả măng cụt khô sẽ không nhiều. Các hợp chất sơ cấp như cellulose, pectin, tinh bột trong các mẫu vỏ quả măng cụt khô chiếm tỷ phần khá lớn, với hơn 40% cellulose, 8% tinh bột và gần 3% pectin (so với khối lượng nguyên liệu khô). Kết quả nghiên cứu của Winuprasith và cộng sự (2013) hay của Mai và cộng sự (2015) cũng chỉ ra cellulose, pectin, protein, là các hợp chất sơ cấp chủ yếu trong vỏ quả măng cụt [31, 32]. Các hợp chất này tham gia cấu trúc tạo nên thành tế bào thực vật, bao học và giữ các hoạt chất bên trong tế bào, chúng là những rào cản tự nhiên đối với quá trình trích ly các hoạt chất từ vỏ quả măng cụt. Ngoài ra, hiện tượng gel hoá của pectin sẽ khiến cho độ nhớt của hỗn hợp tăng gây cản trở sự tiếp cận của dung môi và hoạt chất, đồng thời cản trở quá trình lọc trong. Để phá vỡ rào cản tự nhiên của các hợp chất sơ cấp như cellulose, pectin, protein, v.v, tạo điều kiện cho sự xâm nhập của dung môi và giải phóng các hoạt chất, gần đây nhiều nghiên cứu đã ứng dụng các kỹ thuật hỗ trợ quá trình trích ly như siêu âm, vi sóng hay sử dụng các loại enzym khác nhau để thuỷ phân các hợp chất này, v.v... Các kỹ thuật hỗ trợ này đã nâng cao hiệu suất thu các hoạt chất, giảm thời gian khai thác và bảo tồn được hoạt tính của các chiết xuất [52], [59-65], [69, 70]. Từ những phân tích này chúng tôi đã lựa chọn kỹ thuật siêu âm và sử dụng chế phẩm enzym Pectinex® Ultra SP-L (với hỗn hợp 3 loại enzym: 63 pectinase, hemicellulose và beta-glucanase) để xử lý nguyên liệu trước khi khai thác các hợp chất có hoạt tính sinh học từ vỏ quả măng cụt. Sau khi phân tích thành phần hoá học cơ bản của vỏ quả măng cụt khô tại 6 địa phương đại diện cho các khu vực trồng măng cụt ở Việt Nam cho thấy không có sự khác biệt quá lớn về hàm lượng các thành phần cơ bản của vỏ quả măng cụt giữa các vùng; Vỏ quả măng cụt khô Việt Nam là nguồn nguyên liệu tiềm năng để khai thác các hợp chất polyphenol (chiếm 19,29 ÷23,34 (% chất khô)), tanin (11,54÷14,50 (% chất khô)). 3.2. Nghiên cứu thu nhận chiết xuất giàu các hợp chất có hoạt tính sinh học từ vỏ quả măng cụt Việt Nam 3.2.1. Nghiên cứu thu nhận chiết xuất giàu hoạt chất bằng phương pháp trích ly với dung môi thông thường Dung môi được lựa chọn nghiên cứu là những dung môi có khả năng hoà tan tốt các hợp chất polyphenol, bảo tồn được các hoạt tính của nó và đảm bảo độ an toàn cao, phù hợp với mục đích ứng dụng chiết xuất trong công nghệ thực phẩm. Trong nghiên cứu này chúng tôi lựa chọn dung môi ethanol, đây là loại dung môi phổ biến được nhiều nghiên cứu sử dụng hiệu quả trong khai thác các hợp chất phenolic [28, 50]. Tuy nhiên sử dụng với nồng độ bao nhiêu, trong điều kiện nhiệt độ, thời gian như thế nào để hiệu quả trích ly cần xem xét. Sự ảnh hưởng của các yếu tố này tới quá trình trích ly thu nhận các hợp chất có hoạt tính từ vỏ quả măng cụt đã chúng tôi khảo sát, kết quả nghiên cứu thể hiện trong Hình 3.1-3.4. 3.2.1.1. Ảnh hưởng của nồng độ dung môi Hình 3.1. Ảnh hưởng của nồng độ dung môi tới hiệu suất trích ly các hợp chất polyphneol Kết quả Hình 3.1 chỉ ra rằng khi tăng nồng độ ethanol từ 30 (%, thể tích) lên 60% hiệu suất trích ly các hợp chất polyphneol đã được tăng lên. Giá trị tối đa của hiệu suất trích ly là 82,24% ứng với ethanol 60%. Tuy nhiên, khi nồng độ ethanol tăng trên 60% lên 96% thì hiệu suất trích ly polyphenol lại có xu hướng giảm xuống, giá 30 40 50 60 70 80 90 30 40 50 60 70 80 90 96 H iệ u s u ấ t tr ic h l y ( % ) Nồng độ dung môi ethanol (%) 64 trị thấp nhất là 49,08% ứng với nồng độ ethanol 96% (thấp hơn cả so với ethanol 30%). Hiện tượng tương tự cũng gặp phải trong nghiên cứu của Chew và cộng sự (2011), dung môi ethanol có nồng độ 40% ÷60% cho khả năng thu nhận polyphenol cao hơn so với các nồng độ ngoài khoảng này [156]. Kết quả nghiên cứu khác của Dušan và cộng sự (2014) cho thấy hàm lượng polyphenol đại mạch khi chiết bằng ethanol 90% giảm hơn 2/3 so với ở nồng độ 30% [157]. Hay trong nghiên cứu của Ni Putu Ermi Hikmawant và cộng sự (2020), hàm lượng polyphenol chiết xuất từ lá Katuk giảm từ 42,18 xuống 16,25 (mgGAE/g) khi nồng độ ethanol tăng từ 50% tới 96% [158]. Điều này có thể giải thích là do sự thay đổi tỷ phần giữa ethanol và nước trong dung môi khiến cho độ phân cực của dung môi thay đổi. Nước là chất phân cực mạnh (với hằng số điện môi là 80,1) trong khi đó ethanol lại thuộc nhóm phân cực yếu (với hằng số điện môi 24,55, thấp hơn rất nhiều so với nước). Do đó khi tăng nồng độ ethanol đồng nghĩa với sự giảm hàm lượng nước trong dung môi sẽ khiến cho độ phân cực của dung môi giảm. Ngoài ra, polyphenol là một nhóm lớn bao gồm nhiều hợp chất hữu cơ khác nhau như tanin, xanthone, anthocyanin, ... , chúng có cấu tạo hoá học khác nhau, do đó khả năng tương tác, khả năng hoà tan khác nhau trong dung môi có độ phân cực khác nhau. Trong khi nhóm hợp chất tanin có khả năng hoà tan trong nước thì các hợp chất xanthone lại hoà tan trong các dung môi hữu cơ có độ phân cực thấp hơn. Việc thay đổi tỷ lệ nước trong hệ dung môi theo hướng quá cao hoặc quá thấp đều làm cho khả năng hoà tan một vài nhóm chất polyphenol bị giảm khiến cho hiệu suất thu nhận polyphenol tổng số giảm. Vì vậy, các dung môi nguyên chất không phải là dung môi tốt nhất, sự pha trộn các dung môi tạo hệ dung môi có độ phân cực vừa phải sẽ cho hiệu quả tách chiết các hợp chất polyphenol tốt nhất [159]. Từ kết quả nghiên cứu (Hình 3.1) cho thấy với dung môi ethanol 60% cho hiệu suất trích ly polyphenol tổng số từ vỏ quả măng cụt cao nhất. Chúng tôi lựa chọn ethanol 60% để làm dung môi trích ly phục vụ cho các nghiên cứu tiếp theo. 3.2.1.2. Ảnh hưởng của tỷ lệ nguyên liệu và dung môi Sự chênh lệch về nồng độ chất tan ảnh hưởng đến sự khuếch tán của chất tan từ trong thành tế bào vào dung môi. Khi tăng lượng nguyên liệu, nó sẽ làm giảm độ chênh lệch về nồng độ chất tan giữa môi trường và bên trong tế bào thực vật, do đó làm giảm khả năng khuếch tán các hợp chất này ra khỏi tế bào. Kết quả nghiên cứu ảnh hưởng của tỷ lệ nguyên liệu/dung môi thể hiện ở Hình 3.2 đã phản ánh quy luật này, khi tỷ lệ dung môi tăng (từ 1/10 đến 1/20), hiệu suất trích ly tanin (polyphenol) tăng lên và lớn nhất ở tỷ lệ 1/20 (hiệu suất trích ly là 82,24%). Tuy nhiên, khi lượng dung môi tiếp tục tăng từ 1/30 đến 1/40 thì hiệu suất trích ly tanin (polyphenol) lại có xu hướng giảm. Hiện tượng này cũng gặp phải khi Zhe-xiong Jin và cộng sự (2010) chiết tách tanin từ thảo mộc [160] và có thể giải thích là do lượng dung môi 65 50 60 70 80 90 100 30 60 90 120 150 H iệ u s u ấ t tr íc h l y ( % ) Thời gian trích ly (Phút) quá lớn, tế bào thực vật bị trạng thái trương nở quá mức và các chất tan đã bị hấp thụ vào trong tế bào. Ngoài ra, việc sử dụng quá nhiều dung môi sẽ gia tăng chi phí. Tỷ lệ bột vỏ quả măng cụt với dung môi là 1/20 (g /mL) đã được chúng tôi lựa chọn cho các khảo sát tiếp theo. Hình 3.2. Ảnh hưởng của tỷ lệ nguyên liệu/dung môi tới hiệu suất trích ly các hợp chất polyphneol 3.2.1.3. Ảnh hưởng của thời gian trích ly Thời gian có ý nghĩa rất quan trọng tới việc khai thác triệt để, tiết kiệm chi phí sản xuất và sự bảo tồn của các hoạt chất trong dịch chiết thô. Ảnh hưởng của thời gian tới hiệu suất trích ly polyphenol từ vỏ quả măng cụt mô tả trên Hình 3.3. Hình 3.3. Ảnh hưởng của thời gian trích ly tới hiệu suất trích ly polyphenol tổng số từ vỏ quả măng cụt Kết quả nghiên cứu thể hiện trên Hình 3.3 cho thấy, lượng tanin (polyphenol) tổng số tăng khi tăng thời gian trích ly và cho kết quả tốt nhất sau 120 phút (hiệu suất trích ly đạt 82,24%). Tuy nhiên khi kéo dài thời gian trích ly ở 60oC lâu hơn nữa (lên tới 150 phút) thì hàm lượng polyphenol tổng số thu được có xu hướng giảm. Lý giải về hiện tượng tăng hiệu suất trích ly khi tăng thời gian từ 30 phút lên 40 50 60 70 80 90 1:10 1:20 1:30 1:40 H iệ u s u ấ t tr íc h l y ( % ) Tỷ lệ NL/DM (g/mL) 66 50 60 70 80 90 100 30 40 50 60 70 80 90 H iệ u s u ấ t tr íc h l y ( % ) Nhiệt độ trích ly (oC) 120 phút là do: quá trình khuếch tán chất tan từ nội bào ra ngoài môi trường (dung môi) cần một khoảng thời gian nhất định. Nếu thời gian trích ly ngắn sẽ bỏ sót một lượng hoạt chất sâu bên trong tế bào thực vật chưa kịp tiếp cận và hoà tan vào dung môi. Khi tăng thời gian trích ly sẽ tạo điều kiện cho nhiều hoạt chất được hoà tan hơn, do đó trích ly được triệt để hơn, hiệu suất trích ly hoạt chất tăng. Nhưng nếu thời gian trích ly kéo dài sẽ dẫn đến hiện tượng các hoạt chất mới được giải phóng bị tác động bởi các yếu tố bên ngoài như oxy không khí, ánh sáng, ... dẫn tới các chuyển hoá bất lợi, gây hao hụt hoạt chất trong dịch chiết thô. Điển hình sự thoái hoá dưới tác động của oxy, ánh sáng mặt trời, nhiệt độ cao, ... là nhóm hợp chất anthocyanin. Nghiên cứu của Dam Sao Mai và cộng sự (2013) cũng cho thấy sản lượng chiết xuất nhóm anthocyanin giảm khi thời gian trích ly kéo dài hơn 40 phút ở nhiệt độ cao [48]. Ngoài phá huỷ ở nhiệt độ cao thì việc kéo dài thời gian trích ly cũng khiến cho nhiều hoạt chất sau khi được giải phóng sẽ tương tác với nhau hoặc bị thoái hoá dưới tác động của môi trường xung quanh đặc biệt là sự có mặt của oxy không khí. Đồng thời tiến hành trích ly kéo dài sẽ khiến cho chi phí năng lượng tăng, ảnh hưởng tới hiệu quả kinh tế. Thực nghiệm cho thấy 120 phút là khoảng thời gian đủ để trích ly các hợp chẩt polyphenol. Từ kết quả nghiên cứu trên, chúng tôi đã lựa chọn thời gian trích ly là 120 phút để thực hiện cho các nghiên cứu tiếp theo. 3.2.1.4. Ảnh hưởng của nhiệt độ trích ly Dung môi ethanol 60% có điểm sôi cao hơn 90oC, vì vậy chúng tôi đã nghiên cứu ảnh hưởng của nhiệt độ trích ly trong phạm vi nhiệt độ từ 30oC đến 90oC [161]. Kết quả nghiên cứu ảnh hưởng của nhiệt độ trích ly tới hiệu suất thu nhận các hợp c
File đính kèm:
 luan_an_nghien_cuu_thu_nhan_mot_so_nhom_hop_chat_co_hoat_tin.pdf
luan_an_nghien_cuu_thu_nhan_mot_so_nhom_hop_chat_co_hoat_tin.pdf Bản trích yếu luận án- Nguyễn Thị Hiền.docx
Bản trích yếu luận án- Nguyễn Thị Hiền.docx Bản trích yếu luận án- Nguyễn Thị Hiền.pdf
Bản trích yếu luận án- Nguyễn Thị Hiền.pdf Thông tin đưa lên mạng- LATS Nguyễn Thị Hiền.docx.docx
Thông tin đưa lên mạng- LATS Nguyễn Thị Hiền.docx.docx Thông tin đưa lên mạng- LATS Nguyễn Thị Hiền.pdf
Thông tin đưa lên mạng- LATS Nguyễn Thị Hiền.pdf Tóm tắt LATS_ Nguyễn Thị Hiền.docx
Tóm tắt LATS_ Nguyễn Thị Hiền.docx Tóm tắt LATS_ Nguyễn Thị Hiền.pdf
Tóm tắt LATS_ Nguyễn Thị Hiền.pdf

