Luận án Nghiên cứu xử lý nâng cao nước thải chứa thuốc nhuộm hoạt tính bằng phương pháp điện hóa với điện cực chọn lọc

Trang 1

Trang 2

Trang 3

Trang 4
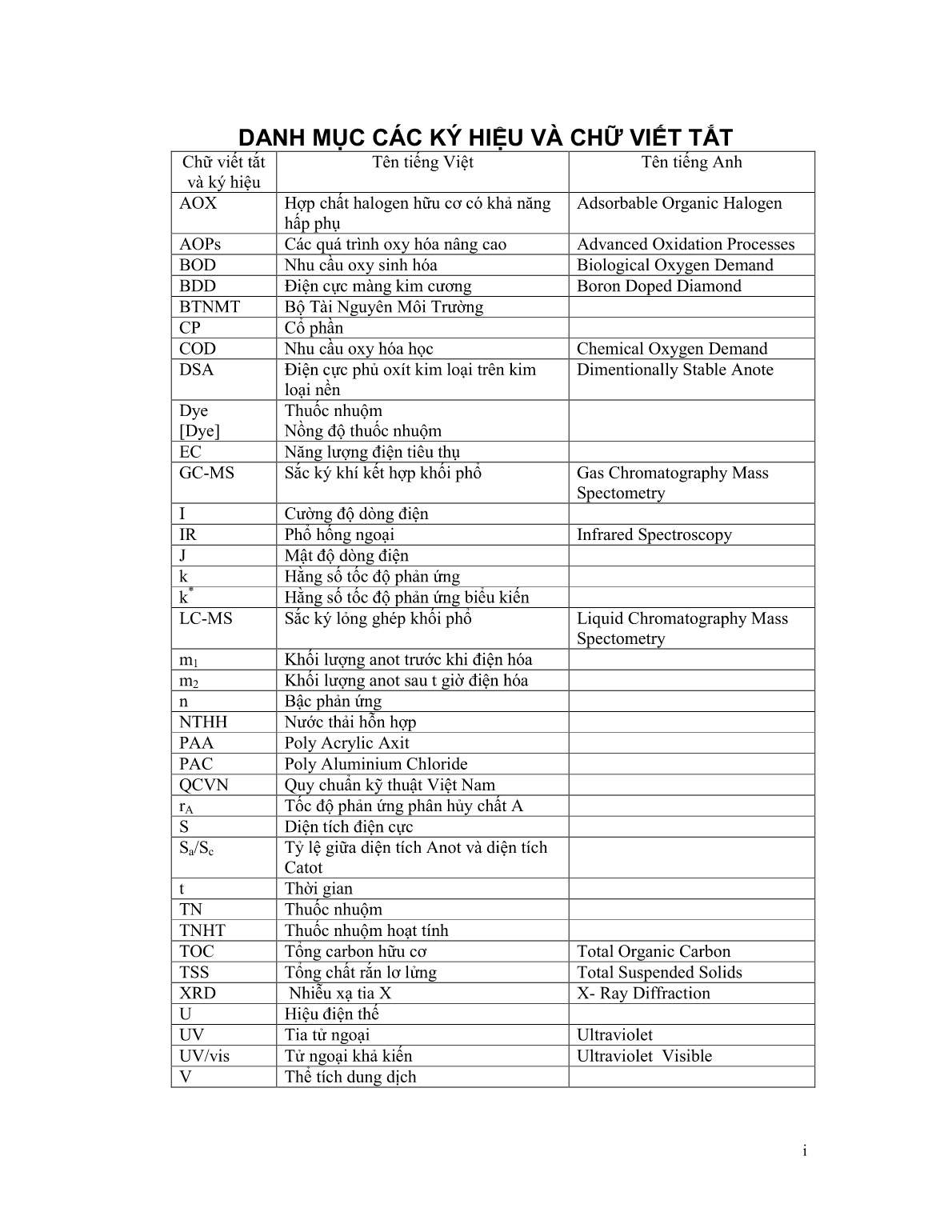
Trang 5

Trang 6

Trang 7

Trang 8

Trang 9

Trang 10
Tải về để xem bản đầy đủ
Bạn đang xem 10 trang mẫu của tài liệu "Luận án Nghiên cứu xử lý nâng cao nước thải chứa thuốc nhuộm hoạt tính bằng phương pháp điện hóa với điện cực chọn lọc", để tải tài liệu gốc về máy hãy click vào nút Download ở trên.
Tóm tắt nội dung tài liệu: Luận án Nghiên cứu xử lý nâng cao nước thải chứa thuốc nhuộm hoạt tính bằng phương pháp điện hóa với điện cực chọn lọc

ộ Trong thực tế, nước thải từ quá trình nhuộm thường có nhiệt độ khoảng 40 0C [40]. Để nghiên cứu ảnh hưởng của nhiệt độ lên hiệu suất xử lý độ màu và độ giảm hàm lượng COD của quá trình xử lý điện hóa bằng điện cực thép Ferosilic, tiến hành thay đổi nhiệt độ ứng với các giá trị từ 250C- 40 0C. Bảng 2.5. Điều kiện tiến hành thí nghiệm ảnh hưởng của nhiệt độ Điều kiện làm việc Nước thải màu hỗn hợp Nước thải màu đỏ và màu vàng Thể tích dung dịch hỗn hợp (ml) 200 200 Diện tích điện cực (cm2) 13 13 Khoảng cách điện cực (cm) 2,0 2,0 pH 3 3 Thời gian điện hóa (phút) 30 15 Mật độ dòng điện (mA/cm2) 15,1 7,6 NaCl (g/l) 0,5 0,5 Nhiệt độ thay đổi (0C) 25, 30, 35, 40 25, 30, 35, 40 b) Các điều kiện thực nghiệm nghiên cứu ảnh hưởng của thành phần nước thải xử lý Một trong những yếu tố có ảnh hưởng nhiều lên hiệu quả xử lý của quá trình điện hóa là sự có mặt của các ion khác trong nước thải xử lý. Trong thực tế, khi nhuộm các thuốc nhuộm có chứa nhóm hoạt tính vinylsulphone phải thực hiện trong môi trường pH cao (11 – 11,5) (thường sử dụng NaOH hoặc Na2CO3 để điều chỉnh môi trường) và sử dụng một 48 lượng lớn các chất điện ly như NaCl, Na2SO4 để tăng tốc độ nhuộm. Các hóa chất này bị thải ra hoàn toàn sau quá trình nhuộm. Sự có mặt của các ion này có thể có ảnh hưởng đến hiệu suất xử lý của phương pháp điện hóa. Lượng Na2SO4 và Na2CO3 có trong nước thải dệt nhuộm thay đổi tùy thuộc vào loại thuốc nhuộm sử dụng và thường dao động trong khoảng rộng [1, 58, 131]. Trong phần này, tiến hành nghiên cứu sự ảnh hưởng của Na2SO4 và Na2CO3 đến hiệu suất xử lý màu và độ giảm hàm lượng COD của phương pháp điện hóa để có thể áp dụng vào xử lý nước thải dệt nhuộm thực. - Ảnh hưởng của Na2SO4 Nghiên cứu ảnh hưởng của nồng độ Na2SO4 đến hiệu suất xử lý được tiến hành với điều kiện ban đầu như thí nghiệm trên, ở nhiệt độ môi trường và thay đổi nồng độ chất điện ly Na2SO4 với các giá trị trong khoảng từ 0,005M đến 0,05M. Tiến hành xử lý điện hóa trong 5 phút. - Ảnh hưởng của Na2CO3 Nghiên cứu xác định ảnh hưởng của nồng độ Na2CO3 đến hiệu suất xử lý được tiến hành với điều kiện ban đầu như thí nghiệm trên, nồng độ chất điện ly Na2SO4: 0,005M. Nồng độ chất điện ly Na2CO3 thay đổi ứng với các giá trị trong khoảng từ 0,005M đến 0,02M. c) Ảnh hưởng của tỷ lệ diện tích giữa các điện cực Để nghiên cứu ảnh hưởng của tỷ lệ diện tích giữa điện cực anot và điện cực catot Sa/Sc đến hiệu quả suy giảm COD và độ màu của phương pháp, thay đổi tỷ lệ diện tích Sa/Sc ứng với các giá trị tương ứng là 0,5; 1; 1,5; 2; 2,5. Các điều kiện thí nghiệm khác như mật độ dòng điện: 15 mA/cm2 ; pH= 3 và hàm lượng NaCl = 0,5 g/l được giữ nguyên trong quá trình thí nghiệm. Tiến hành xử lý điện hóa nước thải chứa TNHT màu hỗn hợp trong 30 phút. 2.2.2. Các phương pháp xử lý số liệu 2.2.2.1. Phương pháp quy hoạch thực nghiệm Phương pháp quy họach thực nghiệm cho phép giảm được số lượng thí nghiệm cần thiết, hàm lượng thông tin nhiều, đánh giá được vai trò qua lại giữa các yếu tố và ảnh hưởng của chúng tới hàm mục tiêu, xác định được điều kiện tối ưu đa yếu tố của đối tượng nghiên cứu một cách khá chính xác bằng công cụ toán học thay cho cách giải gần đúng tìm tối ưu cục bộ như các thực nghiệm thụ động. Với vật liệu điện cực thép Ferosilic đã lựa chọn, để xác định chế độ làm việc tối ưu cho hiệu quả xử lý cao và tiết kiêm năng lượng của quá trình xử lý điện hóa nước thải chứa TNHT màu hỗn hợp, tiến hành tổ chức thí nghiệm theo phương án quy hoach trực giao bậc 2. Căn cứ vào kết quả khảo sát ảnh hưởng của các yếu tố tới quá trình xử lý nước thải chứa TNHT màu hỗn hợp bằng phương pháp điện hóa với điện cực anot là thép Ferosilic, lựa chọn các thông số chính ( Z1, Z2, Z3...) có ảnh hưởng lớn tới hiệu quả xử lý màu của nước thải chứa hỗn hợp TNHT. Xác định hàm mục tiêu cần đạt được (Y). Để quy hoạch thực nghiệm trực giao bậc 2, bố trí thí nghiệm thay đổi đồng thời các yếu tố. Mỗi yếu tố tiến hành ở 3 mức: Mức trên, mức dưới và mức cơ sở để thí nghiệm ở tâm phương án. Xây dựng hàm mục tiêu cần đạt được. 49 Bảng 2.6. Số thí nghiệm lặp tại tâm Số thí nghiệm tại tâm kế hoạch Biến thực Hàm mục tiêu Z1 0 Z2 0 Z3 0 Yi 0 1 2 min1max1 ZZ 2 min2max2 ZZ 2 min3max3 ZZ Y1 0 2 2 min1max1 ZZ 2 min2max2 ZZ 2 min3max3 ZZ Y2 0 3 2 min1max1 ZZ 2 min2max2 ZZ 2 min3max3 ZZ Y3 0 Mức trên của các yếu tố - Zj max Mức dưới của các yếu tố - Zj min Mức cơ sở của các yếu tố - 0 jZ Điểm với tọa độ 0 0 0 01 2 3; ; ;...; kZ Z Z Z gọi là tâm của kế hoạch. Để tiện cho việc tính toán, chuyển từ hệ trục tự nhiên 0 0 0 01 2 3; ; ;...; kZ Z Z Z có thứ nguyên sang hệ trục mới không thứ nguyên mã hóa x1; x2; x3; ; xk theo công thức: k1,j ; maxmax j o jj j Z ZZ x (2.2) k1,j ; minmin j o jj j Z ZZ x (2.3) 0 0 0 ; 1, j j j j Z Z x j k Z (2.4) Trong hệ tọa độ không thứ nguyên axm jx luôn bằng +1; min jx luôn bằng -1 và tọa độ tâm kế hoạch 0 jx luôn bằng 0 và trùng với gốc tọa độ. Để nhận được phương trình hồi quy, ta tiến hành tổ chức thí nghiệm theo kế hoạch thực nghiệm bậc 2 trực giao với số thí nghiệm là : N= 2k-1 +2.k+n0 (2.5) Trong đó: k là số yếu tố ảnh hưởng no : là số thí nghiệm ở tâm Sử dụng phần mềm modde 5.0 nhập giá trị của các yếu tố thay đổi Z1, Z2, Z3, phần mềm chạy ngẫu nhiên thu được ma trận làm việc. Tiến hành làm thí nghiệm tại các điểm của ma trận, thu được giá trị của các hàm mục tiêu tương ứng. Để làm kế hoạch trực giao hoàn toàn, biến đổi bình phương theo các công thưc PL1.1; PL1.2 (phụ lục 1). Sau khi mã hóa, phương trình hồi qui có dạng: y = bo + b1x1 + b2x2 + b3x3 + b4x4 + b5x5 + b11x1 x1 + b22x2 x2 + b33x3 x3 + b44x4 x4 + b55x5 x5 + b12x1 x2 + b13x1 x3 + b14x1 x4 + b15 x1x5 + b23x2 x3 + b24x2 x4 + b25x2x5 + b34x3 x4 + b35x3x5 + b45x4 x5 50 Tính toán các hệ số của phương trình hồi quy đối với các hàm mục tiêu dựa trên các công thức PL1.4; PL1.5; PL1.6; PL1.7; PL1.8 (phụ lục 1). Phần mềm cho các giá trị của hệ số hồi quy. Kiểm tra mức ý nghĩa của các hệ số bj theo chuẩn số Student. Kiểm định sự tương hợp của mô hình bằng chuẩn số Fisher hoặc sai số trung bình (%). Xác định chế độ làm việc tối ưu cho quá trình sử dụng mô hình modde 5.0. 2.2.2.2 Phương pháp xây dựng phương trình động học phản ứng oxy hóa điện hóa phân hủy thuốc nhuộm hoạt tính trong nước thải (động học hình thức). Phản ứng giữa chất hữu cơ và gốc hydroxyl tuân theo phản ứng : A + OH* → Sản phẩm Tốc độ của phản ứng hóa học được định nghĩa là mức độ suy giảm nồng độ chất hữu cơ trong môi trường phản ứng theo thời gian [112]. �� = − ��� �� = ��� ���∗ (2.6) Trong đó : COH là nồng độ của gốc hydroxyl k là hằng số tốc độ phản ứng Trong phản ứng trên có 2 yếu tố có tác động đến tốc độ phản ứng là nồng độ chất tham gia phản ứng (CA và COH*) và hằng số tốc độ k. Để tính toán hằng số tốc độ phản ứng k và bậc của phản ứng ta giả định nồng độ của gốc hydroxyl OH* không đổi để đưa biểu thức về dạng phương trình giả bậc 1 theo nồng độ chất ô nhiễm. �� = − ��� �� = ��� ���∗ = � ∗ �� Trong đó : k* = k COH* Sự đúng đắn của giả định sẽ được kiểm chứng thông qua các phép kiểm tra tính tương hợp của phương trình động học. Mô hình xác định động học phản ứng theo phương pháp này đã được sử dụng khá phổ biến trong nhiều kết quả nghiên cứu đã được công bố quốc tế trong lĩnh vực xử lý nước thải dệt nhuộm bằng phương pháp điện hóa [55,61,136]. Tiến hành xác định hằng số tốc độ phản ứng giả bậc 1 Xét phản ứng : kA P Trong đó : A – chất ban đầu P – sản phẩm Đối với phản ứng này, CA là nồng độ chất A. Giả thiết phản ứng phân hủy chất hữu cơ A trong nước thải đơn giản, một chiều, bậc phản ứng giả bậc 1. Tốc độ phản ứng phân huỷ chất A (rA) bằng: �� = − ��� �� = �∗ �� k* - hằng số tốc độ biểu kiến phản ứng phân hủy thuốc nhuộm giả bậc 1, phút-1 Tích phân từ 0 đến t ta được : − � ��� �� �� ��� = �∗ � �� � � −�� �� ��� = �∗� = �(�) (2.7) 51 Dựng đồ thị - 0 ln ( )A A C f t C theo kết quả thực nghiệm thu được, đồ thị này có dạng đường thẳng với hệ số góc bằng hằng số tốc độ phản ứng k*. Từ đồ thị xác định hằng số tốc độ phản ứng phân huỷ các thuốc nhuộm của quá trình oxi hóa điện hóa. Xác định sai số và kiểm định sự tương hợp của mô hình động học Sai số tuyệt đối Si giữa giá trị thực nghiệm và giá trị tính toán tại thí nghiệm thứ i bằng: �� = |�� − ��| (2.8) Sai số trung bình được xác định như sau: ��� = ∑ �� � ��� ∑ �� � ��� ∗ 100% = ∑ |�����| � ��� ∑ �� � ��� ∗ 100% (2.9) Trong đó: yi - giá trị thực nghiệm đo được ở thí nghiệm thứ i ��- giá trị tính toán theo mô hình động học N - số thí nghiệm Si - sai số tuyệt đối giữa giá trị thực nghiệm và giá trị tính toán tại thí nghiệm thứ i; STB - sai số trung bình đối với cả dãy N thí nghiệm tính theo %. Nếu sai số trung bình ≤ 10% thì mô hình động học phản ứng tương hợp và cũng có nghĩa là giải thiết về nồng độ [OH*] không đổi và phản ứng giả bậc 1 là phù hợp. 2.2.2.3. Phương pháp xác định hiệu quả xử lý 1. Xác định hiệu suất giảm COD và độ màu Lượng chất hữu cơ bị oxy hóa được đánh giá bằng độ suy giảm chỉ số COD trước và sau xử lý. %��� = ��������� ���� x 100 % (2.10) Trong đó : CODo và CODt là COD ban đầu và COD tại thời điểm t 2. Hiệu suất xử lý độ màu Hiệu suất khử màu của phương pháp điện hóa được xác định theo công thức : Độ �à� � � Độ �à� � Độ �à� � x 100% (2.11) 2.2.2.4. Phương pháp xác định năng lượng điện tiêu thụ Công thức tính năng lượng điện tiêu thụ cho quá trình xử lý điện hóa được xác định theo công thức [110,41] EC = ��� �.�×(����� ����)×� (kWh kgCOD� ) (2.12) Trong đó: U : Hiệu điện thế cấp cho hệ thống (V). I : Cường độ dòng điện (A). t : Thời gian xử lý điện hóa (s). V : Thể tích mẫu (L). CODt , CODs : COD trước và sau điện hóa (g O2/L). 52 2.2.3. Các phương pháp phân tích 1. Đo độ màu Pt – Co [TCVN6185: 2008] 2. Phân tích COD của mẫu nước thải theo phương pháp “Hồi lưu đóng” [TCVN6491: 1999] Trong quá trình chuẩn bị mẫu để thực hiện phân tích COD cần chú ý loại bỏ sự ảnh hưởng của Clo đến kết quả phân tích COD bằng cách sử dụng HgSO4. Phương pháp phân tích này đã được nhiều nghiên cứu sử dụng để xác định COD của nước thải dệt nhuộm chứa TNHT trước xử lý và sau xử lý điện hóa [60,114]. 3. Xác định lượng Fe2+, Fe3+, Tổng Fe [ TCVN 6177:1996, 48] 4. Xác định lượng ion Clo [TCVN 6194: 1996]. 5. Xác định BOD5 của mẫu nước thải theo phương pháp pha loãng [TCVN 6001-1 : 2008 ] 6. Phân tích sắc ký khí kết hợp với khối phổ GC-MS GC-MS là phương pháp kết hợp sắc kí khí với khối phổ kế. Ứng dụng GC-MS để định danh và xác định cấu truc của các hợp chất hữu cơ trung gian dễ bay hơi được tạo ra trong quá trình xử lý. Việc nhận danh một chất dựa trên cơ sở so sánh khối phổ thu được trong thí nghiệm với một thư viện khối phổ của các chất đã được xác định trước. Các mẫu nước thải được phân tích GC-MS tại phòng thí nghiệm của Trung tâm dịch vụ phân tích thí nghiệm thành phố Hồ Chí Minh trực thuộc Sở Khoa học và Công nghệ. Các mẫu nước thải gửi phân tích được bảo quản và vận chuyển tuân theo đúng TCVN 6663-3: 2008. 7. Phân tích phổ hồng ngoại (IR) Phổ hồng ngoại cung cấp thông tin quan trọng về cấu trúc phân tử nhanh, không đòi hỏi các phương pháp phân tích phức tạp. Các đám phổ khác nhau có mặt trong phổ hồng ngoại tương ứng với các nhóm định chức đặc trưng và các liên kết có trong phân tử hợp chất hóa học. Có thể căn cứ vào kết quả phổ hồng ngoại để nhận dạng các chất. Phổ IR được phân tích theo kỹ thuật ép viên mẫu với KBr theo tỷ lệ: mẫu/KBr = 1/100, đo trên máy FT-IR Nicolet 6700 (Mỹ) ở nhiệt độ phòng trong vùng hồng ngoại từ 400 ÷ 4000 cm-1 tại phòng thí nghiệm công nghệ Lọc hóa dầu và Vật liệu xúc tác hấp phụ, Viện Kỹ thuật Hóa học, Trường Đại học Bách khoa Hà Nội. 8. Phân tích sắc ký lỏng ghép phổ khối LC-MS Phân tích sắc khí lỏng ghép khối phổ LC-MS được sử dụng để xác định các hợp chất hữu cơ chưa biết bằng cách dựa vào khối lượng của phân tử hợp chất của từng phần tác riêng của nó. LC-MS định danh và xác định cấu trúc hợp chất hữu cơ, định lượng vi lượng (phân tích vết). Mẫu được phân tích LC-MS tại phòng thí nghiệm của Trung tâm dịch vụ phân tích thí nghiệm thành phố Hồ Chí Minh trực thuộc Sở Khoa học và Công nghệ . Các mẫu nước thải gửi phân tích được bảo quản và vận chuyển tuân theo đúng TCVN 6663-3: 2008. 9. Phân tích phổ nhiễu xạ tia X (XRD) Khi đo phổ XRD người ta sẽ thu được 2 thông tin là đỉnh phổ và cường độ đỉnh phổ. Đỉnh phổ đặc trưng cho mạng tinh thể có trong chất rắn, điều này có nghĩa nó đặc trưng cho những chất cụ thể trong vật rắn. Cường độ đỉnh phổ đặc trưng cho mức độ tinh thể hóa 53 của chất đó. Theo lý thuyết thì lượng vật chất của chất đó càng nhiều thì đỉnh phổ càng cao. Bằng cách so sánh phổ và đỉnh phổ đo được với phổ và định phổ của vật chất tinh khiết, người ta có thể tính toán và suy ra trong khối vật rắn đó có những chất gì và hàm lượng bao nhiêu. Sử dụng phương pháp XRD để xác định thành phần pha và cấu trúc tinh thể. Mẫu được phân tích XRD tại phòng thí nghiệm của Trung tâm dịch vụ phân tích thí nghiệm thành phố Hồ Chí Minh trực thuộc Sở Khoa học và Công nghệ. Các mẫu nước thải gửi phân tích được bảo quản và vận chuyển tuân theo đúng TCVN 6663-3: 2008. 10. Chụp kim tương cấu trúc tế vi của vật liệu điện cực Sau khi được chế tạo, để sử dụng làm điện cực anot trong quá trình xử lý điện hóa nước thải chứa TNHT, mẫu vật liệu điện cực thép Ferosilic được soi và chụp lại ảnh tổ chức tế vi trên kính hiển vi quang học Axiovert 25A với độ phóng đại cao nhất 1000 lần - Carl Zeiss Gottingen (Đức), tại phòng thí nghiệm của Bộ môn Vật liệu – Viện Khoa học và Kỹ thuật Vật liệu - Đại học Bách khoa Hà nội. 54 CHƯƠNG 3 – KẾT QUẢ VÀ THẢO LUẬN 3.1. Tính chất của các loại vật liệu điện cực sử dụng trong nghiên cứu. 3.1.1. Đường cong phân cực các vật liệu điện cực nghiên cứu Kết quả đo đường cong phân cực của các vật liệu điện cực Pt, thép SUS 304 và thép Ferosilic trong dung dịch nước thải chứa TNHT màu hỗn hợp được thể hiện trong hình 3.1(a,b,c). (a) (b) 55 (c) Hình 3.1. Đường cong phân cực của điện cực Pt (a), thép Ferosilic (b) và thép SUS 304 (c) trong nước thải dệt nhuộm chứa TNHT Từ các đường cong phân cực trên có thể thấy quá trình catot hầu như bị ảnh hưởng không nhiều, trong khi đó các quá trình anot có sự khác nhau rõ rệt đối với mỗi loại vật liệu điện cực. Đường cong phân cực của các vật liệu nghiên cứu được chia thành 3 vùng : - Vùng hoạt động : là vùng có thế thấp và kim loại bị ăn mòn bình thường. Thép SUS 304 có vùng thế hoạt động từ -450 mV ÷ 10 mV, thép Ferosilic từ - 400 mV ÷ 0 mV và Pt nằm trong khoảng 500 mV ÷ 1000 mV. - Vùng thụ động : từ điện thế Etd (điện thế khởi đầu thụ động) trở lên mật độ dòng điện đột ngột giảm xuống tới giá trị nhỏ hơn, kim loại bắt đầu trở nên thụ động (mất khả năng hòa tan), mật độ dòng ứng với Etd được gọi là mật độ dòng tới hạn ith . Điện cực Pt có vùng thế thụ động tương đối rộng nằm trong khoảng từ 1000 mV ÷ 1500 mV. Thép SUS 304 có mật độ dòng tới hạn là 0,31. 10-4 mA/cm2 và thép Ferosilic có mật độ dòng tới hạn khoảng 0,33. 10-4 mA/cm2. Vùng điện thế thụ động của cả 2 vật liệu điện cực này đều rộng như nhau và nằm trong khoảng từ 0 mV ÷ 310 mV. - Vùng quá thụ động : tiếp tục dịch chuyển điện thế về phía dương hơn, mật độ dòng ăn mòn đột ngột tăng lên. Vùng điện thế này được gọi là vùng quá thụ động, là vùng mà kim loại bị hòa tan hoàn toàn thành các ion kim loại có hóa trị cao hơn. Giá trị điện thế quá thụ động của thép SUS 304, thép Ferosilic và Pt lần lượt 320 mV, 310 mV và 1500 mV. Từ kết quả thu được có thể thấy Pt là một kim loại có độ bền điện hóa rất cao. Nó là loại điện cực trơ không tan khi phân cực anot, điều này phù hợp với các kết quả nghiên cứu trước đây đã kết luận [29, 35, 45, 66]. Các điện cực thép SUS 304 và thép Ferosilic đều khá bền khi phân cực anot. 56 Từ kết quả đo đường cong phân cực của các vật liệu anot thép Ferosilic và thép SUS 304 trong dung dịch nước thải chứa TNHT trên hình 3.1 (b) và hình 3.1 (c) rút ra được sự phụ thuộc của dòng anot vào điện thế như trong bảng 3.1. và bảng 3.2. Bảng 3.1. Sự phụ thuộc của dòng anot vào điện thế của vật liệu điện cực thép Ferosilic trong dung dịch nước thải chứa TNHT Điện thế E (V) Log (i) ( dòng anot) (A/cm2) -0,25 10-5 -0,1 0,26. 10-4 0,1 0,26.10-4 0,32 0,19. 10-4 0,45 0,21. 10-4 0,55 0,28. 10-4 0,65 0,33. 10-4 0,75 0,45. 10-4 Bảng 3.2. Sự phụ thuộc của dòng anot vào điện thế của vật liệu điện cực thép SUS 304 trong dung dịch nước thải chứa TNHT Điện thế E (V) Log (i) ( dòng anot) (A/cm2) -0,352 10-5 -0,1 0,24. 10-4 0,1 0,28.10-4 0,33 0,19. 10-4 0,45 0,24. 10-4 0,55 0,31. 10-4 0,65 0,5. 10-4 0,75 1,7. 10-3 Kết quả xác định điện thế ổn định theo thời gian của các điện cực Pt, Thép Ferosilic và thép SUS 304 trong dung dịch trước xử lý điện hóa và sau xử lý điện hóa được trình bày trong hình 3.2 (a,b). (a) 57 (b) Hình 3.2. Điện thế ổn định của các vật liệu điện cực trong dung dịch nước thải chứa TNHT trước xử lý điện hóa (a) và sau xử lý điện hóa (b) Kết quả trên đồ thị hình 3.2 (a,b) cho thấy trong cùng một môi trường điện ly, các vật liệu điện cực khác nhau sẽ có điện thế ổn định khác nhau. Pt là một vật liệu điện cực trơ nên điện thế ổn định của nó trong dung dịch nước thải dương hơn rất nhiều so với các vật liệu điện cực hợp kim thép. Mặt khác, kết quả cũng cho thấy điện thế ổn định của các loại vật liệu điện cực anot trong dịch nước thải trước xử lý điện hóa và sau xử lý điện hóa có sự khác nhau. Điện thế ổn định của các vật liệu điện cực trong dung dịch sau xử lý điện hóa đều có xu hướng chuyển về phía âm hơn do sau khi điện hóa thành phần các tạp chất giảm xuống. Điện cực Ferosilic có điện thế ổn định dương hơn (- 0,4V) so với điện thế ổn định của thép SUS 304 (- 0,45 V). Khi vật liệu có điện thế âm lớn hơn thì sự hoà tan của điện cực anot tăng lên làm tăng tổn thất vật liệu điện cực hay nói cách khác khi điện thế ổn định của điện cực càng âm thì điện cực càng kém bền điện hoá [18]. Ở đây điện cực Ferosilic có độ bền điện hóa cao hơn thép SUS 304. Theo đồ thị hình 3.1 (b,c), dòng thụ động của 2 loại vật liệu hợp kim thép ở trong khoảng điện thế hẹp gần như nhau, nhưng khi phân cực anot lớn đến +0,75 V thì dòng anot của thép Ferosilic (khoảng 0,45. 10-4 mA/cm2) nhỏ hơn dòng anot của thép SUS 304 (khoảng 1,7.103 mA/cm2 ). Điều này có nghĩa tốc độ hòa tan của thép SUS 304 lớn hơn khá nhiều so với thép Ferosilic. Ngoài ra, các kết quả trên đồ thị hình 3.1 và các bảng 3.1, bảng 3.2 cho thấy cả 2 vật liệu điện cực đều có khoảng điện thế thụ động gần như nhau nhưng dòng thụ động anot của vật liệu thép Ferosilic nhỏ hơn. Khi phân cực ở điện thế lớn hơn 0,5 V thì dòng hòa tan anot của thép SUS 304 tăng lên nhiều hơn so với thép Ferosilic. Khảo sát bề mặt điện cực thép SUS 304 sau một thời gian điện phân cho thấy trên bề mặt có xuất hiện các lỗ ăn mòn điểm, chứng tỏ đã có sự hòa tan cục bộ. Thép SUS 304 là vật liệu thường được bảo vệ bằng một lớp màng thụ động trên bề mặt. Trong quá trình điện phân ở điện thế lớn, lớp 58 màng thụ động này có thể bị phá vỡ dẫn đến vật liệu sẽ bị ăn mòn lỗ (hình PL11 phụ lục 3). Với vật liệu thép Ferosilic, hiện tượng ăn mòn điểm không xảy ra trong quá trình xử lý. 3.1.2. Độ hòa tan của điện cực thép SUS 304 và thép Ferosilic Để khẳng định khi vật liệu có điện thế âm lớn hơn thì độ hoà tan của nó tăng lên do đó làm tăng tổn thất khối lượng điện cực, tiến hành khảo sát độ hoà tan của các điện cực anot thép SUS 304 và thép Ferosilic. Từ kế
File đính kèm:
 luan_an_nghien_cuu_xu_ly_nang_cao_nuoc_thai_chua_thuoc_nhuom.pdf
luan_an_nghien_cuu_xu_ly_nang_cao_nuoc_thai_chua_thuoc_nhuom.pdf

