Tóm tắt Luận án Nghiên cứu chế tạo vật liệu composit oxit sắt/các bon định hướng ứng dụng trong tích trữ năng lượng

Trang 1
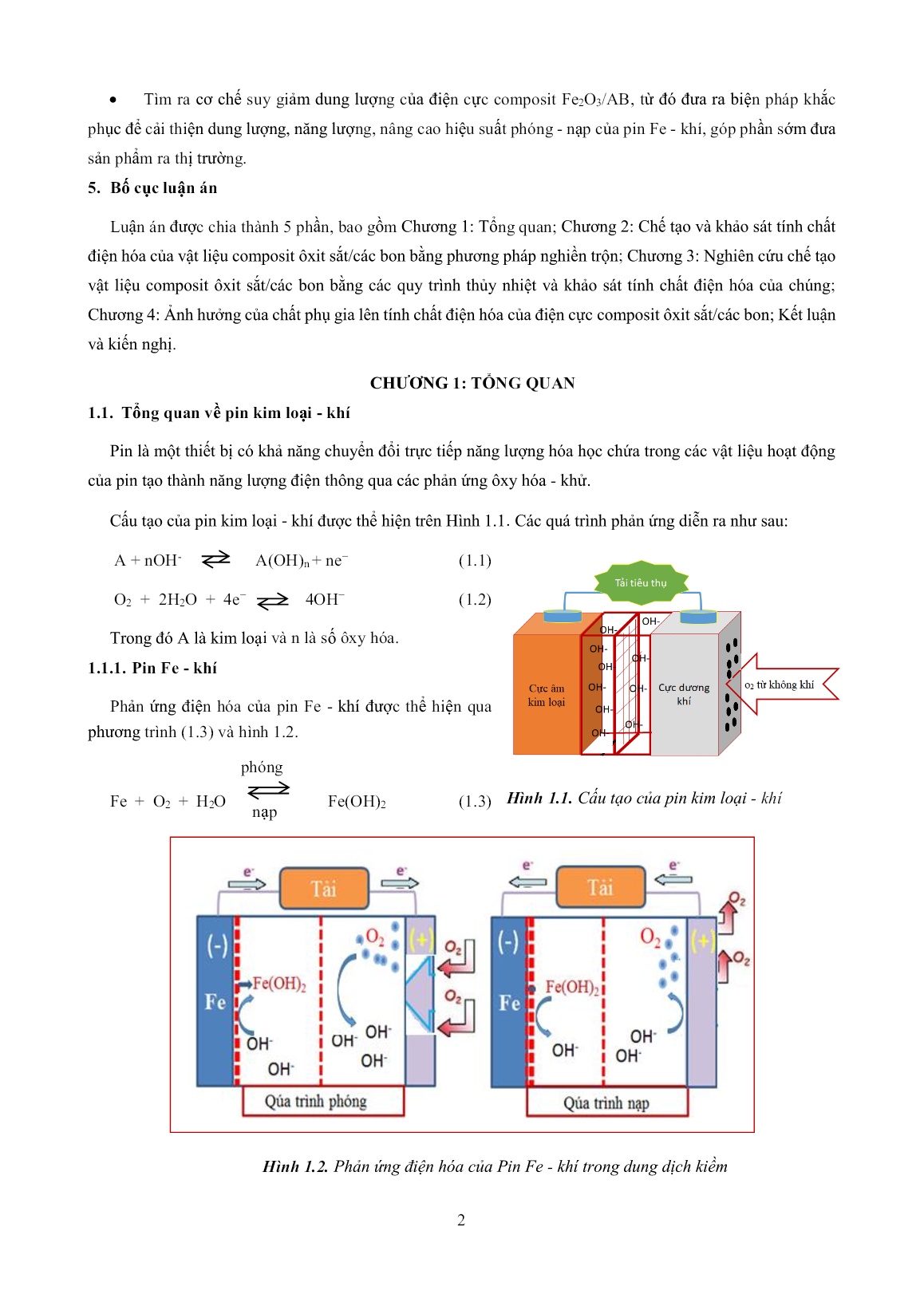
Trang 2

Trang 3

Trang 4
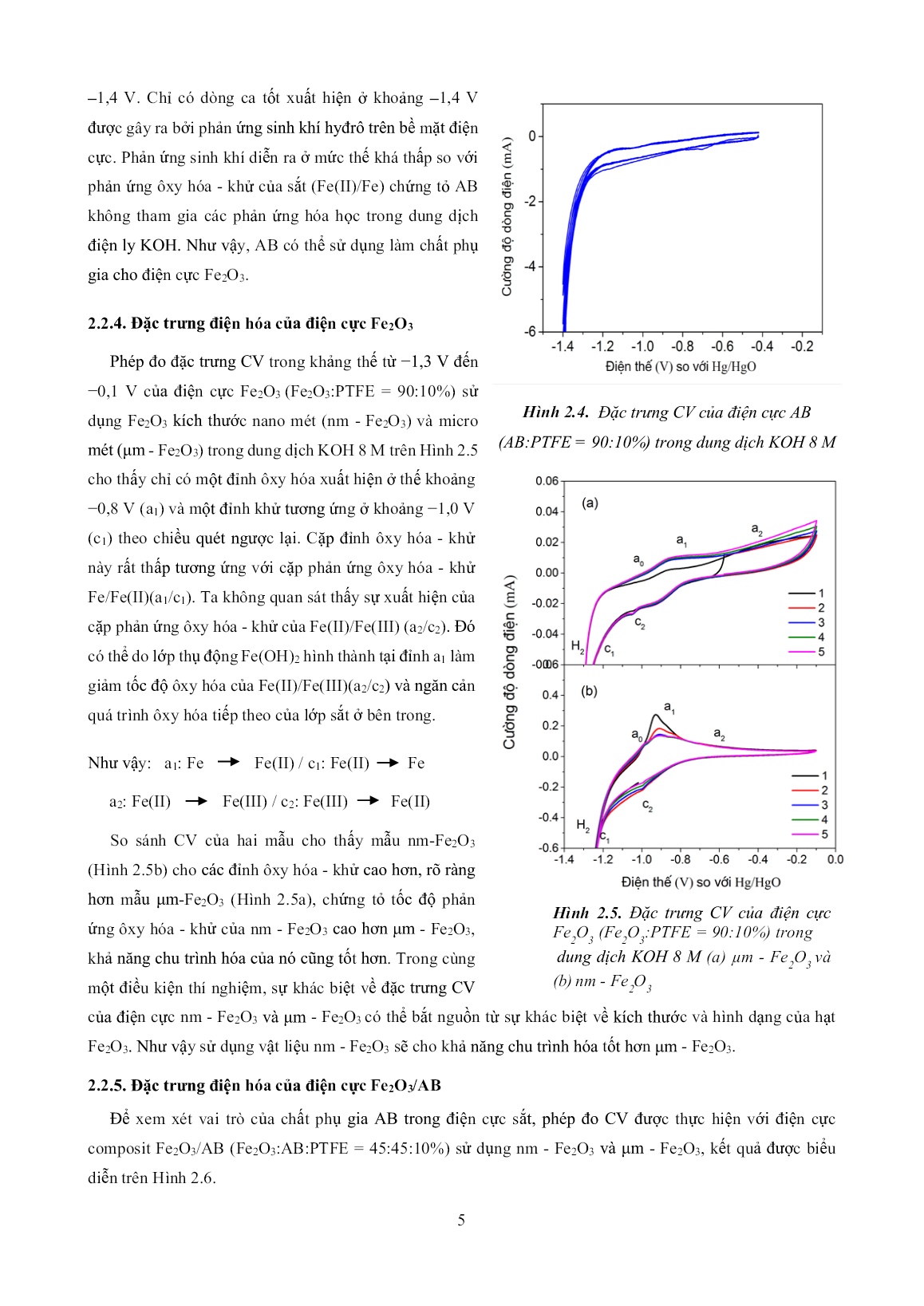
Trang 5
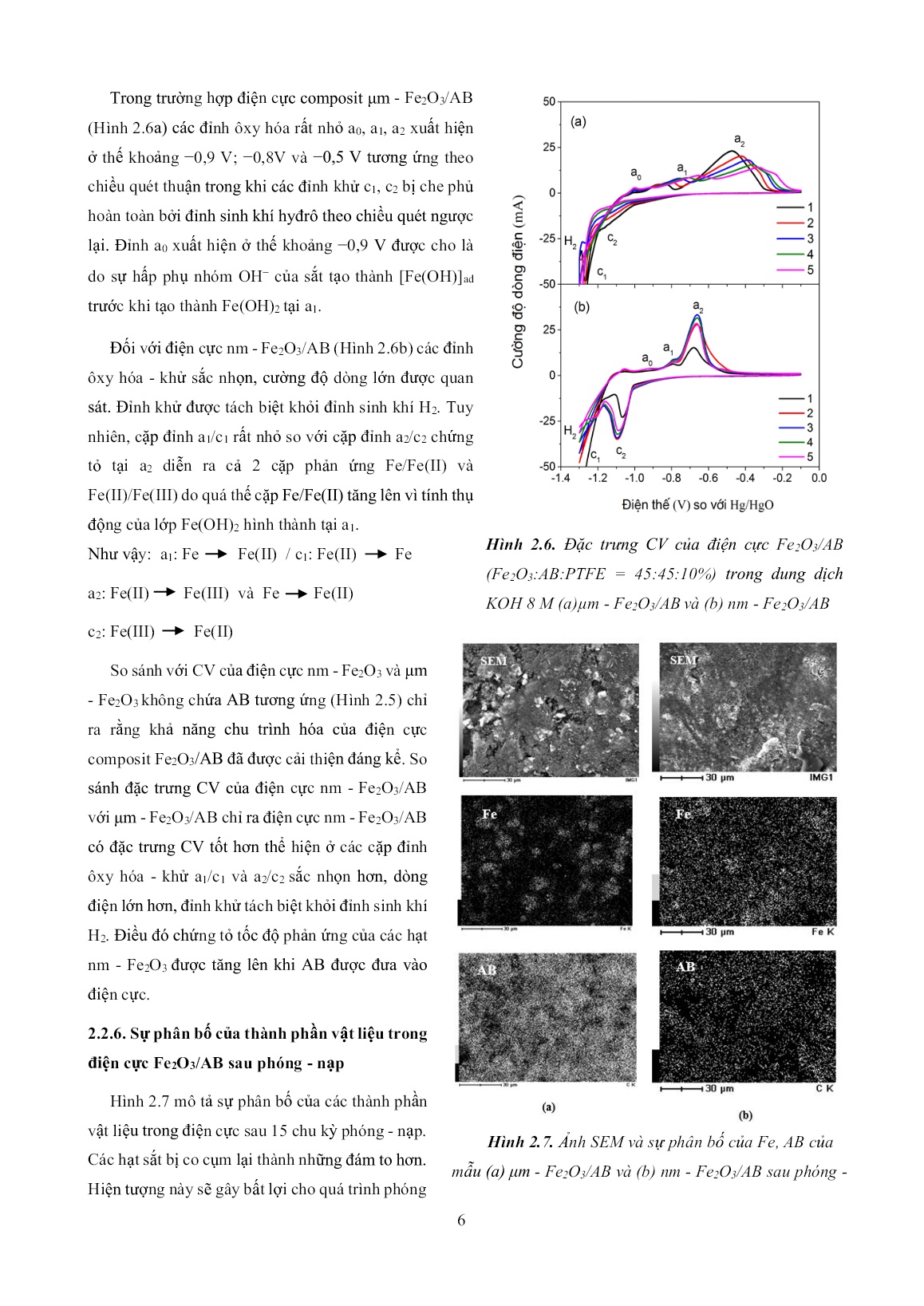
Trang 6
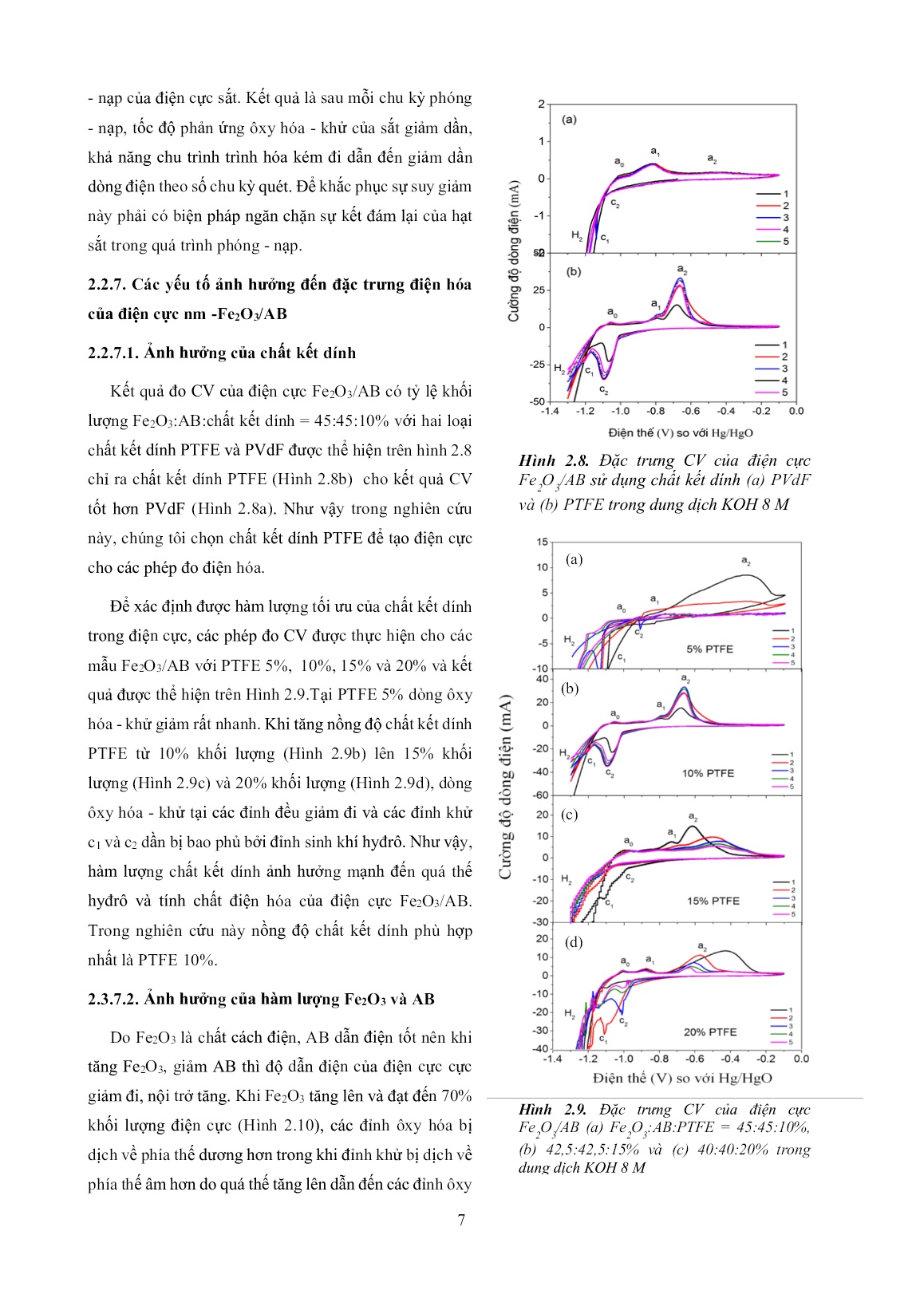
Trang 7
Trang 8

Trang 9

Trang 10
Tải về để xem bản đầy đủ
Bạn đang xem 10 trang mẫu của tài liệu "Tóm tắt Luận án Nghiên cứu chế tạo vật liệu composit oxit sắt/các bon định hướng ứng dụng trong tích trữ năng lượng", để tải tài liệu gốc về máy hãy click vào nút Download ở trên.
Tóm tắt nội dung tài liệu: Tóm tắt Luận án Nghiên cứu chế tạo vật liệu composit oxit sắt/các bon định hướng ứng dụng trong tích trữ năng lượng

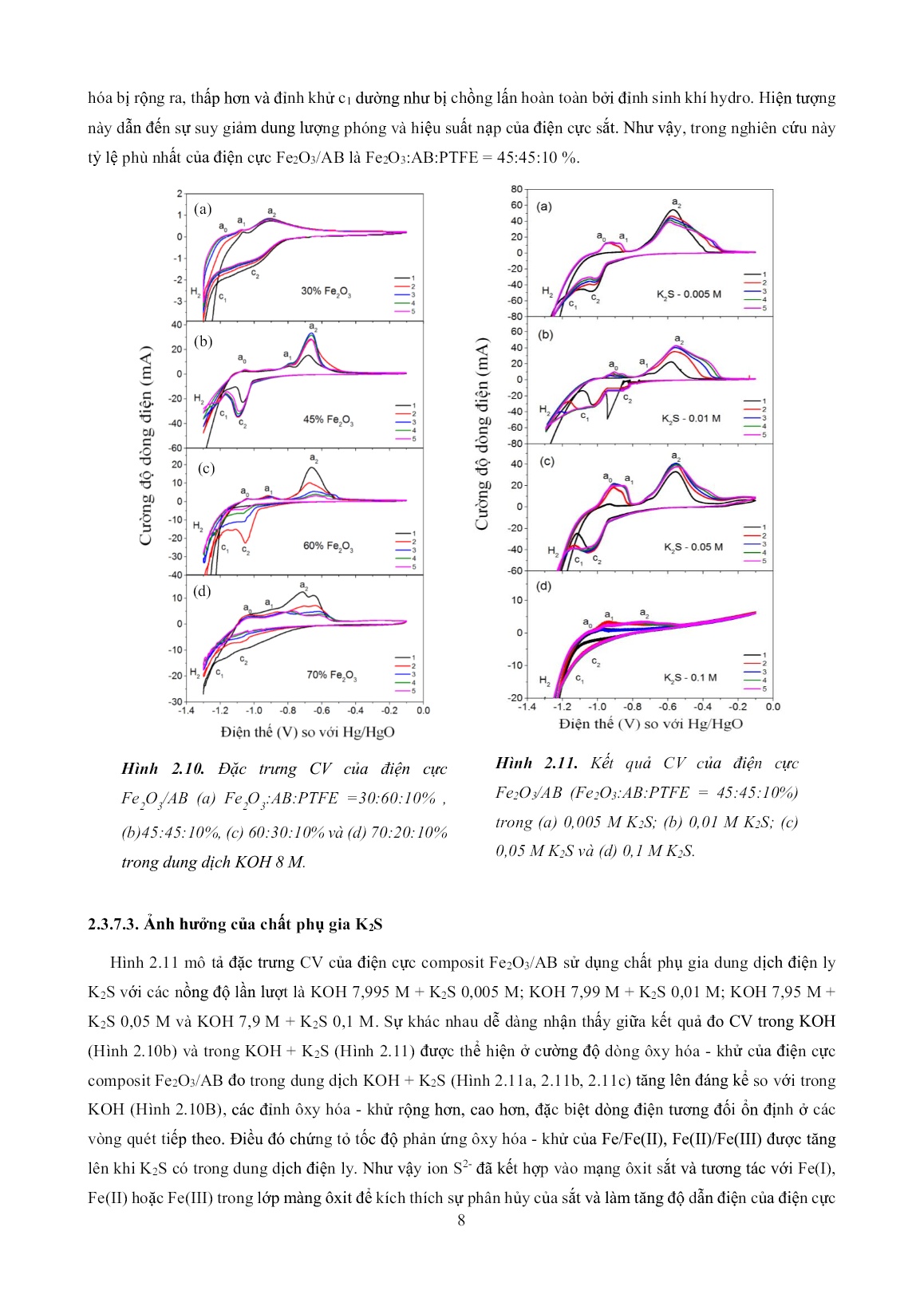
phóng - nạp. 2.2.7. Các yếu tố ảnh hưởng đến đặc trưng điện hóa của điện cực nm -Fe2O3/AB 2.2.7.1. Ảnh hưởng của chất kết dính Kết quả đo CV của điện cực Fe2O3/AB có tỷ lệ khối lượng Fe2O3:AB:chất kết dính = 45:45:10% với hai loại chất kết dính PTFE và PVdF được thể hiện trên hình 2.8 chỉ ra chất kết dính PTFE (Hình 2.8b) cho kết quả CV tốt hơn PVdF (Hình 2.8a). Như vậy trong nghiên cứu này, chúng tôi chọn chất kết dính PTFE để tạo điện cực cho các phép đo điện hóa. Để xác định được hàm lượng tối ưu của chất kết dính trong điện cực, các phép đo CV được thực hiện cho các mẫu Fe2O3/AB với PTFE 5%, 10%, 15% và 20% và kết quả được thể hiện trên Hình 2.9.Tại PTFE 5% dòng ôxy hóa - khử giảm rất nhanh. Khi tăng nồng độ chất kết dính PTFE từ 10% khối lượng (Hình 2.9b) lên 15% khối lượng (Hình 2.9c) và 20% khối lượng (Hình 2.9d), dòng ôxy hóa - khử tại các đỉnh đều giảm đi và các đỉnh khử c1 và c2 dần bị bao phủ bởi đỉnh sinh khí hyđrô. Như vậy, hàm lượng chất kết dính ảnh hưởng mạnh đến quá thế hyđrô và tính chất điện hóa của điện cực Fe2O3/AB. Trong nghiên cứu này nồng độ chất kết dính phù hợp nhất là PTFE 10%. 2.3.7.2. Ảnh hưởng của hàm lượng Fe2O3 và AB Do Fe2O3 là chất cách điện, AB dẫn điện tốt nên khi tăng Fe2O3, giảm AB thì độ dẫn điện của điện cực cực giảm đi, nội trở tăng. Khi Fe2O3 tăng lên và đạt đến 70% khối lượng điện cực (Hình 2.10), các đỉnh ôxy hóa bị dịch về phía thế dương hơn trong khi đỉnh khử bị dịch về phía thế âm hơn do quá thế tăng lên dẫn đến các đỉnh ôxy Hình 2.8. Đặc trưng CV của điện cực Fe 2 O 3 /AB sử dụng chất kết dính (a) PVdF và (b) PTFE trong dung dịch KOH 8 M Hình 2.9. Đặc trưng CV của điện cực Fe 2 O 3 /AB (a) Fe 2 O 3 :AB:PTFE = 45:45:10%, (b) 42,5:42,5:15% và (c) 40:40:20% trong dung dịch KOH 8 M (a) (b) (c) (d) 8 hóa bị rộng ra, thấp hơn và đỉnh khử c1 dường như bị chồng lấn hoàn toàn bởi đỉnh sinh khí hydro. Hiện tượng này dẫn đến sự suy giảm dung lượng phóng và hiệu suất nạp của điện cực sắt. Như vậy, trong nghiên cứu này tỷ lệ phù nhất của điện cực Fe2O3/AB là Fe2O3:AB:PTFE = 45:45:10 %. 2.3.7.3. Ảnh hưởng của chất phụ gia K2S Hình 2.11 mô tả đặc trưng CV của điện cực composit Fe2O3/AB sử dụng chất phụ gia dung dịch điện ly K2S với các nồng độ lần lượt là KOH 7,995 M + K2S 0,005 M; KOH 7,99 M + K2S 0,01 M; KOH 7,95 M + K2S 0,05 M và KOH 7,9 M + K2S 0,1 M. Sự khác nhau dễ dàng nhận thấy giữa kết quả đo CV trong KOH (Hình 2.10b) và trong KOH + K2S (Hình 2.11) được thể hiện ở cường độ dòng ôxy hóa - khử của điện cực composit Fe2O3/AB đo trong dung dịch KOH + K2S (Hình 2.11a, 2.11b, 2.11c) tăng lên đáng kể so với trong KOH (Hình 2.10B), các đỉnh ôxy hóa - khử rộng hơn, cao hơn, đặc biệt dòng điện tương đối ổn định ở các vòng quét tiếp theo. Điều đó chứng tỏ tốc độ phản ứng ôxy hóa - khử của Fe/Fe(II), Fe(II)/Fe(III) được tăng lên khi K2S có trong dung dịch điện ly. Như vậy ion S2- đã kết hợp vào mạng ôxit sắt và tương tác với Fe(I), Fe(II) hoặc Fe(III) trong lớp màng ôxit để kích thích sự phân hủy của sắt và làm tăng độ dẫn điện của điện cực Hình 2.10. Đặc trưng CV của điện cực Fe 2 O 3 /AB (a) Fe 2 O 3 :AB:PTFE =30:60:10% , (b)45:45:10%, (c) 60:30:10% và (d) 70:20:10% trong dung dịch KOH 8 M. Hình 2.11. Kết quả CV của điện cực Fe2O3/AB (Fe2O3:AB:PTFE = 45:45:10%) trong (a) 0,005 M K2S; (b) 0,01 M K2S; (c) 0,05 M K2S và (d) 0,1 M K2S. (a) (b) (c) (d) 9 do đó cải thiện khả năng chu trình hóa của sắt đồng thời làm tăng tốc độ phản ứng khử sắt, giảm quá thế của nó dẫn đến tăng hiệu suất nạp của sắt. Ngoài ra ion S2- hấp phụ trên bề mặt hạt sắt giúp ngăn chặn phản ứng sinh khí H2 . Khi tăng nồng độ K2S lên 0,05 M (Hình 2.11c) đỉnh khử c1 dịch về phía thế âm hơn nên bị che phủ hoàn toàn bởi đỉnh sinh khí H2. Tiếp tục tăng nồng độ K2S lên 0,1 M (Hình 2.11d), các đỉnh ôxy hóa - khử gần như biến mất hoàn toàn. Đó có thể do ở nồng độ K2S cao, tác động mạnh của S2- làm quá thế phản ứng sắt tăng cao dẫn đến các đỉnh ôxy hóa - khử bị dịch ra ngoài khoảng thế quét. Như vậy trong nghiên cứu này, nồng độ K2S phù hợp nhất là 0,01 M (Hình 2.11b) và nồng độ này được sử dụng làm chất phụ gia dung dịch điện ly trong các phần nghiên cứu tiếp theo. 2.3. Kết luận Bằng phương pháp nghiền trộn, chúng tôi đã chế tạo thành công mẫu composit nm - Fe2O3, µm - Fe2O3, nm - Fe2O3/AB và µm - Fe2O3/AB sử dụng vật liệu nm - Fe2O3, µm - Fe2O3 thương mại để tạo ra điện cực sắt cấu trúc xốp nhằm cải thiện những hạn chế của nó. Kết qủa khảo sát cho thấy kích thước, hình dạng hạt Fe2O có ảnh hưởng mạnh đến khả năng chu trình hóa của điện cực Fe2O3. Vật liệu nm - Fe2O3 cho khả năng chu trình hóa tốt hơn vật liệu µm - Fe2O3. Chất phụ gia AB làm tăng độ dẫn điện cực, cải thiện tốc độ phản ứng ôxy hóa - khử của sắt dẫn đến cải thiện khả năng chu trình hóa của điện cực composit nm - Fe2O3/AB. Chất phụ gia dung dịch điện ly K2S ảnh hưởng tích cực đến tính chất điện hóa của điện cực Fe2O3/AB như làm tăng tốc độ phản ứng ôxy hóa của sắt, khử lượng hyđrô sinh ra giúp làm tăng hiệu suất nạp của điện cực. Nồng độ chất phụ gia K2S phù hợp nhất trong dung dịch điện ly KOH là 0,01 M. Trong điện cực composit Fe2O3/AB các thành phần cấu thành như Fe2O3, AB, chất kết dính, hàm lượng của mỗi thành phần đều có ảnh hưởng mạnh đến đặc trưng điện hóa của nó. PTFE là chất kết dính phù hợp nhất để chế tạo điện cực composit Fe2O3/AB và tỷ lệ thành phần khối lượng tối ưu nhất là Fe2O3:AB:PTFE = 45:45:10%. 10 CHƯƠNG 3 NGHIÊN CỨU CHẾ TẠO VẬT LIỆU COMPOSIT ÔXIT SẮT/CÁC BON BẰNG CÁC QUY TRÌNH THỦY NHIỆT VÀ KHẢO SÁT TÍNH CHẤT ĐIỆN HÓA CỦA CHÚNG 3.1. Quy trình thủy nhiệt một bước chế tạo vật liệu Fe2O3 Quy trình thủy nhiệt 1 bước bao gồm 3 quy trình thủy nhiệt khác nhau để chế tạo vật liệu Fe2O3 có hình thái học khác nhau được thể hiện trên hình 3.1, 3.2 và 3.3. Quy trình thủy nhiệt 1: Chế tạo vật liệu Fe2O3 xốp Đầu tiên, hòa tan 0,06 M sắt (III) nitrat (Fe(NO3)3.9H2O) trong 80 ml nước khử ion, sau đó cho thêm 1 ml demethylsulfoxide (DMSO; C2H6SO) vào dung dịch này, khuấy liên tục hỗn hợp này trong 2 giờ để được hỗn hợp đồng nhất. Hỗn hợp dung dịch được đưa vào bình thủy nhiệt 100 ml và thủy nhiệt ở 140oC trong 14 giờ, sau đó bình thủy nhiệt được để nguội dần đến nhiệt độ phòng. Kết tủa màu vàng α-FeOOH thu được bằng cách quay ly tâm, rồi rửa bằng cồn và nước khử ion nhiều lần và sau đó được sấy khô ở 60oC trong 12 giờ. Cuối cùng ủ nhiệt vật liệu kết tủa màu vàng α-FeOOH ở 600oC trong 2 giờ ta thu được bột α-Fe2O3 xốp Quy trình thủy nhiệt 2: Chế tạo vật liệu Fe2O3 cầu rỗng, ống và đĩa Hòa tan hỗn hợp vật liệu gồm 30 mM FeCl3.6H2O và 0,5 mM (NH2)2CO trong 80 ml nước khử ion, sau đó khuấy liên tục hỗn hợp này trong 2 giờ để được dung dịch đồng nhất. Đưa hỗn hợp dung dịch này vào bình thủy nhiệt 100 ml để thủy nhiệt ở 200oC trong 24 giờ, sau đó bình thủy nhiệt được để nguội dần đến nhiệt độ phòng. Kết tủa màu nâu đỏ thu được bằng cách quay ly tâm, rửa bằng cồn và nước khử ion trong nhiều lần sau đó sấy khô ở 60oC trong 12 giờ. Cuối cùng ủ nhiệt kết tủa màu nâu đỏ ở 400oC trong 2 giờ ta thu được bột α-Fe2O3. Quy trình thủy nhiệt 3: Chế tạo vật liệu Fe2O3 dạng hạt tự do, hình cầu, hình que, hình que + lập phương, hình lập phương và hình đa diện. Cho 80 ml dung dịch CTAB (nồng độ thay đổi từ 0,001 đến 0,04 M) vào 80 ml dung dịch FeCl3.6H2O (nồng độ thay đổi từ 0,01 đến 0,07 M) được hòa tan trong nước khử ion, tiếp theo hỗn hợp dung dịch được khuấy từ liên tục trong 2 giờ để được dung dịch đồng nhất. Sau đó nhỏ từ từ dung dịch NH3 vào dung dịch hỗn hợp cho đến khi độ pH bằng 10. Hỗn hợp dung dịch đồng nhất được đưa vào bình thủy nhiệt để thủy nhiệt ở 120oC trong 14 giờ. Bình thủy nhiệt được để nguội dần đến nhiệt độ phòng. Kết tủa màu nâu đỏ thu được bằng cách quay ly tâm, rửa bằng cồn tinh khiết và nước khử ion trong nhiều lần trước khi sấy khô ở 60oC trong 12 giờ. Cuối cùng ủ nhiệt kết tủa màu nâu đỏ ở 400oC trong 2 giờ ta thu được bột α-Fe2O3. 11 3.2. Quy trình thủy nhiệt 2 bước chế tạo vật liệu Fe2O3/AB Quy trình chế tạo vật liệu Fe2O3/AB bằng phương pháp thủy nhiệt gồm hai bước: Bước 1: Chế tạo Fe2O3 bằng phương pháp thủy nhiệt theo quy trình 1, 2 và 3 nêu trên. Chọn ra vật liệu Fe2O3 có đặc trưng điện hóa tốt nhất để tiến hành bước 2. Bước 2: Thủy nhiệt hỗn hợp hạt Fe2O3 với AB để thu được vật liệu Fe2O3/AB. Thủy nhiệt hỗn hợp hạt Fe2O3 với nano các bon AB để thu được vật liệu Fe2O3/AB. 3.3. Kết quả phân tích hình thái, cấu trúc và đặc trưng điện hóa của vật liệu Fe2O3 chế tạo bằng quy trình thủy nhiệt 1 3.3.1. Hình thái và cấu trúc vật liệu Fe2O3 Vật liệu tổng hợp được bằng quy trình thủy nhiệt 1 là -Fe2O3 theo phổ chuẩn ICSD-No 82135 (Hình 3.1). Tùy thuộc vào liều lượng của DMSO ban đầu mà vật liệu Fe2O3 thu được có hình thái học khác nhau như hình lá xốp (Hình 3.2a) gồm các kim nano sắp xếp lại hoặc dạng cầu xốp (Hình 3.2b, 3.2c, 3.2d) gồm các kim nano mọc ra từ 1 điểm tạo thành quả cầu gai xốp. Hình 3.1. Giản đồ nhiễu xạ tia X của vật liệu Fe 2 O 3 tổng hợp bằng quy trình thủy nhiệt 1 ở các nồng độ khác nhau của DMSO: (a) 1 ml, (b) 2 ml, (c) 4 ml và (d) 8 ml Hình 3.2. Ảnh SEM của mẫu Fe2O3 chế tạo theo quy trình thủy thiệt 1: (a) DMSO-1 ml, (b) DMSO- 2 ml, (c) DMSO-4 ml và (d) DMSO-8 ml 12 3.3.2. Đặc trưng điện hóa của điện cực Fe2O3/AB Kết quả đo đặc trưng CV của các điện cực Fe2O3/AB sử dụng Fe2O3 chế tạo theo quy trình thủy nhiệt 1 (Hình 3.3) chỉ ra hình thái học của Fe2O3 có ảnh hưởng mạnh đến tính chất điện hóa của điện cực Fe2O3/AB. Khi lượng DMSO bằng 4 ml hoặc ít hơn (Hình 3.3a, 3.3b và 3.3c), các đỉnh ôxy - hóa khử xuất hiện rõ ràng. Hai đỉnh ôxy hóa được quan sát ở thế khoảng −0,8 V (a1) và −0,65 V (a2) trong khi hai đỉnh khử tương ứng xuất hiện ở xung quanh −1,0 V (c2) và −1,15 V (c1). Ngoài ra một đỉnh nhỏ ôxy hóa a0 đã được quan sát. Khi hàm lượng của DMSO là 8 ml (Hình 3.3d), các đỉnh ôxy hóa nhỏ hơn nhiều và bị dịch về phía điện thế dương hơn trong khi các đỉnh khử dịch về phía điện thế âm hơn gây nên sự tăng quá thế. Hiện tượng này dẫn đến sự biến mất của các đỉnh ôxy hóa - khử. Do mẫu Fe2O3 tổng hợp ở hàm lượng DMSO 8 ml cho Fe2O3 cầu xốp giống DMSO 4 ml nhưng độ xốp của nó lớn hơn nhiều nên gây ra sự tăng nội trở của điện cực Fe2O3/AB dẫn đến giảm tốc độ phản ứng ôxy hóa - khử, giảm dòng điện, tăng quá thế và không quan sát được các đỉnh trên đường CV. Như vậy, trong điều kiện thực nghiệm này, lượng DMSO phù hợp là 4 ml và lượng DMSO tối ưu là 4 ml. Dung lượng phóng của các điện cực Fe2O3/AB (Hình 3.4) sử dụng Fe2O3 tổng hợp được và Fe2O3 thương mại được tính toán từ kết quả đo CV cho thấy các mẫu chế tạo được bằng phương pháp thủy nhiệt cho dung lượng phóng cao hơn mẫu thương mại. Tuy nhiên, dung lượng phóng của các mẫu chế tạo được vẫn bị suy Hình 3.3. Đặc trưng CV của điện cực Fe2O3/AB trong dung dịch KOH 8 M sử dụng Fe2O3 chế tạo theo quy trình thủy nhiệt 1: (a) DMSO-1 ml, (b) DMSO-2 ml (c) DMSO-4 ml và (d) DMSO-8 ml 0 1 2 3 4 5 6 0 100 200 300 400 1 ml DMSO 2 ml DMSO 3 ml DMSO 4 ml DMSO Thương mại Chu kỳ D u n g l ư ợ ng p h ó n g (m A h /g ) Hình 3.4. Dung lượng phóng của điện cực Fe 2 O 3 /AB 13 giảm theo số chu kỳ phóng - nạp. Trong số các mẫu Fe2O3 tổng hợp theo quy trình thủy nhiệt 1, mẫu chế tạo ở DMSO 4 ml cho dung lượng phóng lớn nhất. Điều này một lần nữa khẳng định hình thái học và độ xốp vật liệu Fe2O3 ảnh hưởng mạnh đến đặc trưng điện hóa của điện cực Fe2O3/AB. 3.4. Kết quả phân tích hình thái, cấu trúc và đặc trưng điện hóa của vật liệu Fe2O3 chế tạo bằng quy trình thủy nhiệt 2 3.4.1. Hình thái và cấu trúc vật liệu Fe2O3 Vật liệu tổng hợp được bằng quy trình thủy nhiệt 2 là -Fe2O3 theo phổ chuẩn ICSD-No 82135 (Hình 3.5). Thay đổi liều lượng của (NH2)2CO và Na2HPO4 sẽ cho Fe2O3 có hình thái học khác nhau (hình 3.6) bao gồm Fe2O3 hình cầu rỗng (Hình 3.6a), hình ống (Hình 3.6b) và hình đĩa (Hình 3.6c). 3.4.2. Đặc trưng điện hóa của điện cực Fe2O3/AB Đặc trưng CV của các điện cực Fe2O3/AB sử dụng Fe2O3 chế tạo theo quy trình thủy nhiệt 2 (Hình 3.7) cho thấy cả ba mẫu Fe2O3 hình cầu rỗng, hình ống và đĩa đều cho các đỉnh ôxy hóa - khử rõ ràng, cường độ dòng lớn và độ rộng đỉnh lớn. Các đỉnh ôxy hóa - khử xuất hiện rất rõ ràng, sắc nét chứng tỏ phản ứng ôxy hóa - khử của các cặp Fe/Fe(II)(a1), Fe(II)/Fe(III)(a2) diễn ra thuận lợi. Tuy nhiên, cường độ đỉnh ôxy hóa a1 rất nhỏ so đỉnh a2 chứng tỏ lớp Fe(OH)2 hình thành tại đỉnh a1 vẫn ngăn cản sự ôxy hóa tiếp theo của sắt, làm giảm tốc độ ôxy hóa lớp sắt bên trong dẫn đến tại đỉnh a2 diễn ra cả hai cặp phản ứng ôxy hóa Hình 3.5. Giản đồ nhiễu xạ tia X của vật liệu Fe 2 O 3 tổng hợp bằng quy trình thủy nhiệt 2: (a) (NH 2 ) 2 CO-0,5 mM; (b) (NH 2 ) 2 CO-1 mM và (c) (NH 2 ) 2 CO-2 mM Hình 3.6. Ảnh SEM của mẫu Fe2O3 chế tạo theo quy trình thủy thiệt 2: (a) NH2)2CO-0,5 mM: Fe2O3 hình cầu rỗng, (b) (NH2)2CO-1 mM, Na2HPO4-1mM: Fe2O3 hình ống, (c) (NH2)2CO-2 mM, Na2HPO4-2 mM: Fe2O3 hình đĩa (b) (c) 14 Fe/Fe(II) và Fe(II)/Fe(III). So sánh dáng điệu đường CV của các mẫu với nhau ta thấy có sự khác biệt chứng tỏ kích thước, hình thái học của α-Fe2O3 đã ảnh hưởng đến tính chất điện hóa của điện cực Fe2O3/AB. So sánh dáng điệu đường CV của các mẫu với nhau ta thấy có sự khác biệt chứng tỏ kích thước, hình thái học. So sánh dung lượng phóng của ba mẫu với nhau (Hình 3.8) ta thấy mẫu Fe2O3 cấu trúc cầu rỗng cho giá trị lớn nhất. Như vậy, trong ba mẫu chế tạo được bằng quy trình thủy nhiệt 2, mẫu Fe2O3 cấu trúc cầu rỗng thể hiện đặc trưng điện hóa tốt nhất. 3.5. Kết quả phân tích hình thái, cấu trúc và đặc trưng điện hóa của vật liệu Fe2O3 chế tạo bằng quy trình thủy nhiệt 3 3.5.1. Hình thái và cấu trúc vật liệu Fe2O3 Vật liệu tổng hợp được bằng quy trình thủy nhiệt 3 là -Fe2O3 theo phổ chuẩn ICSD-No 82135 (Hình 3.9). Thay đổi CTAB và hàm lượng muối sắt ban đầu sẽ tạo ra Fe2O3 có kích thước, hình thái học khác nhau (hình 3.10) bao gồm Fe2O3 hình hạt tự do, hình cầu, hình que, hình que + lập phương, hình lập phương, lập phương rỗng và hình đa diện. Kết quả này chứng tỏ rằng CTAB quyết định hình thái học của hạt Fe2O3 trong khi nồng độ muối sắt ban đầu ảnh hưởng đến kích thước hạt Fe2O3. Hình 3.7. Đặc trưng CV của Fe2O3/AB chế tạo theo quy trình thủy nhiệt 2 trong dung dịch KOH 8 M: (a) hình cầu rỗng, (b) hình ống, (c) hình đĩa 0 1 2 3 4 5 6 0 100 200 300 Cầu rỗng Ống Đĩa Thương mại D u n g l ư ợ n g p h ó n g (m A h /g ) Chu kỳ Hình 3.8. Dung lượng của điện cực Fe2O3/AB Hình 3.9. Giản đồ nhiễu xạ tia X của vật liệu α- Fe 2 O 3 tổng hợp bằng quy trình thủy thiệt 3: (a) Fe 2 O 3 dạng hạt, (b ) hình cầu, (c ) dạng que, (d) Fe 2 O 3 dạng que + lập phương, (e) dạng lập phương, (f) Fe 2 O 3 dạng lập phương rỗng, (g) Fe 2 O 3 dạng đa diện 15 3.5.3. Đặc trưng điện hóa của vật liệu Fe2O3/AB Kết quả đo CV (Hình 3.11) cho thấy đường dáng điệu đường CV của các mẫu có dạng tương tự nhau, đều có các đỉnh ôxy hóa - khử sắc nét xuất hiện trong khoảng thế quét. Hai đỉnh ôxy hóa được quan sát ở thế khoảng −0,8 V (a1) và −0,6 V (a2) trong khi hai đỉnh khử tương ứng xuất hiện ở xung quanh −1,0 V (c2) và −1,1 V (c1). Ngoài ra, còn có một đỉnh nhỏ a0 do sự ôxy hóa của sắt tạo thành Fe(OH)ad xuất hiện ở thế khoảng −1,0 V trên đường quét thuận và đỉnh sinh khí H2 được quan sát thấy ở thế khoảng −1,2 V theo chiều quét ngược lại. Cặp đỉnh a1/c1 tương ứng với cặp phản ứng ôxy hóa - khử của Fe/Fe(II) trong khi cặp đỉnh a2/c2 tương ứng với cặp phản ứng ôxy hóa - khử của Hình 3.11. Đặc trưng CV của Fe 2 O 3 /AB chế tạo theo quy trình thủy nhiệt 3 trong dung dịch KOH 8 M: (a) Fe 2 O 3 dạng hạt, (b) Fe 2 O 3 dạng hình cầu, (c) Fe 2 O 3 dạng que, (d) Fe 2 O 3 dạng que + lập phương, (e) Fe 2 O 3 dạng lập phương, (f) Fe 2 O 3 dạng lập phương rỗng, (g) Fe 2 O 3 dạng đa diện Hình 3.10. Kết quả đo SEM của mẫu α-Fe 2 O 3 chế tạo theo quy trình thủy thiệt 3: (a) Fe 2 O 3 dạng hạt, (b ) hình cầu, (c ) dạng que, (d) Fe 2 O 3 dạng que + lập phương, (e) dạng lập phương, (f) Fe 2 O 3 dạng lập phương rỗng, (g) Fe 2 O 3 dạng đa diện Hình 3.12. Dung lượng của điện cực Fe2O3/AB chế tạo theo quy trình thủy nhiệt 3 16 Fe(II)/Fe(III). Đường CV của các mẫu có sự khác biệt chứng tỏ kích thước, hình thái học của hạt Fe2O3 ảnh hưởng mạnh đến đặc trưng điện hóa của điện cực Fe2O3/AB. So sánh dung lượng phóng của các mẫu chế tạo bằng quy trình thủy nhiệt 3 (Hình 3.12) với nhau cho thấy mẫu Fe2O3 lập phương cho dung lượng lớn nhất. Fe2O3 que và que + lập phương cho giá trị thấp hơn Fe2O3 lập phương nhưng cao hơn các mẫu còn lại. Như vậy ba mẫu tốt nhất của ba quy trình thủy nhiệt đã được tìm ra, đó là mẫu Fe2O3 cầu xốp cho quy trình thủy nhiệt 1, mẫu Fe2O3 cầu rỗng cho quy trình thủy nhiệt 2 và mẫu Fe2O3 lập phương cho quy trình thủy nhiệt 3 (Hình 3.13). 3.6. Đặc trưng điện hóa của điện cực Fe2O3/AB chế tạo bằng quy trình thủy nhiệt hai bước Các mẫu Fe2O3 tổng hợp bằng quy trình thủy nhiệt 1 bước có đặc trưng điện hóa tốt nhất được sử dụng trong quy trình thủy nhiệt hai bước nhằm tạo ra tiếp xúc chặt chẽ giữa các hạt Fe2O3 với các bon AB trước khi chế tạo điện cực từ đó giúp giảm nội trở điện cực. Kết quả đặc trưng CV và dung lượng tính toán trong 5 chu kỳ đầu của ba vật liệu Fe2O3 tốt nhất của 3 quy trình thủy nhiệt cho thấy dáng điệu đường CV của mẫu Fe2O3/AB thủy nhiệt 2 bước (Hình 3.14) không khác so với CV mẫu Fe2O3/AB thủy nhiệt 1 bước, tuy nhiên giá trị dung lượng phóng của các mẫu thủy nhiệt hai bước (Hình 3.15) cao hơn dung lượng phóng của mẫu thủy nhiệt 1 bước (Hình 3.13) mặc dù tỷ lệ giữa các Hình 3.15. Dung lượng của điện cực Fe2O3/AB chế tạo bằng các quy trình thủy nhiệt 2 bước Hình 3.13. Dung lượng của điện cực Fe2O3/AB chế tạo bằng các quy trình thủy nhiệt 1 bước Hình 3.14. Đặc trưng CV và dung lượng của Fe 2 O 3 /AB chế tạo theo quy trình thủy nhiệt hai bước trong dung dịch KOH 8M: (a) Fe 2 O 3 -dạng cầu xốp, (b) Fe 2 O 3 -dạng cầu rỗng, (c) Fe 2 O 3 -dạng lập phương 17 thành phần trong hai mẫu như nhau. Như vậy phương pháp thủy nhiệt 2 bước đã cải thiện dung lượng của cả ba mẫu đại diện cho 3 quy trình thủy nhiệt. 3.7. ĐẶC TRƯNG ĐIỆN HÓA CỦA ĐIỆN CỰC Fe2O3/AB SỬ DỤNG VẬT LIỆU Fe2O3 CÓ KÍCH THƯỚC MICRO MÉT 3.7.1. Hình thái học của vật liệu Fe2O3 Các kết quả nghiên cứu ở phần trên chỉ ra rằng vật liệu Fe2O3 tổng hợp được bằng phương pháp thủy nhiệt đều có kích thước nhỏ, dưới 1 µm. Bột µm - Fe2O3 có cấu trúc rhombohedral (khối hộp thoi) và polyhedral (khối đa diện) (Hình 3.15) được TS. Nguyễn Việt Long cung cấp để chúng tôi khảo sát tính chất điện hóa của điện cực Fe2O3/AB nhằm so sánh với vật liệu chế tạo được. 3.7.2. Đặc trưng điện hóa của điện cực Fe2O3/AB sử dụng vật liệu µm-Fe2O3 Hình 3.16 biểu diễn kết quả đo đặc trưng CV của các điện cực composit Fe2O3/AB sử dụng Fe2O3 - rhombohedral và polyhedral cho thấy các đường CV có dáng điệu tương tự nhau cho cả hai trường hợp. Hai đỉnh ôxy hóa được quan sát ở thế khoảng −0,85 V (a1) và −0,65 V (a2) trong khi hai đỉnh khử xuất hiện lần lượt ở thế khoảng −0,9 V (c1) và −1,1 V (c2). Ngoài ra còn có sự xuất hiện một đỉnh ôxy hóa nhỏ a0 ở thế khoảng −1,0 V và phản ứng sinh khí hyđrô quan sát thấy ở khoảng −1,2 V. Tương tự như mẫu nm - Fe2O3 tổng hợp được bằng phương pháp thủy nhiệt, mẫu µm - Fe2O3 vẫn có hiện tượng giảm dòng điện theo số chu kỳ quét. Đó là do bản chất thụ động của lớp Fe(OH)2 được hình thành tro
File đính kèm:
 tom_tat_luan_an_nghien_cuu_che_tao_vat_lieu_composit_oxit_sa.pdf
tom_tat_luan_an_nghien_cuu_che_tao_vat_lieu_composit_oxit_sa.pdf

