Tóm tắt Luận án Nghiên cứu sinh tổng hợp và thu nhận axit poly γ glutamic và hướng ứng dụng trong thực phẩm

Trang 1

Trang 2

Trang 3

Trang 4

Trang 5
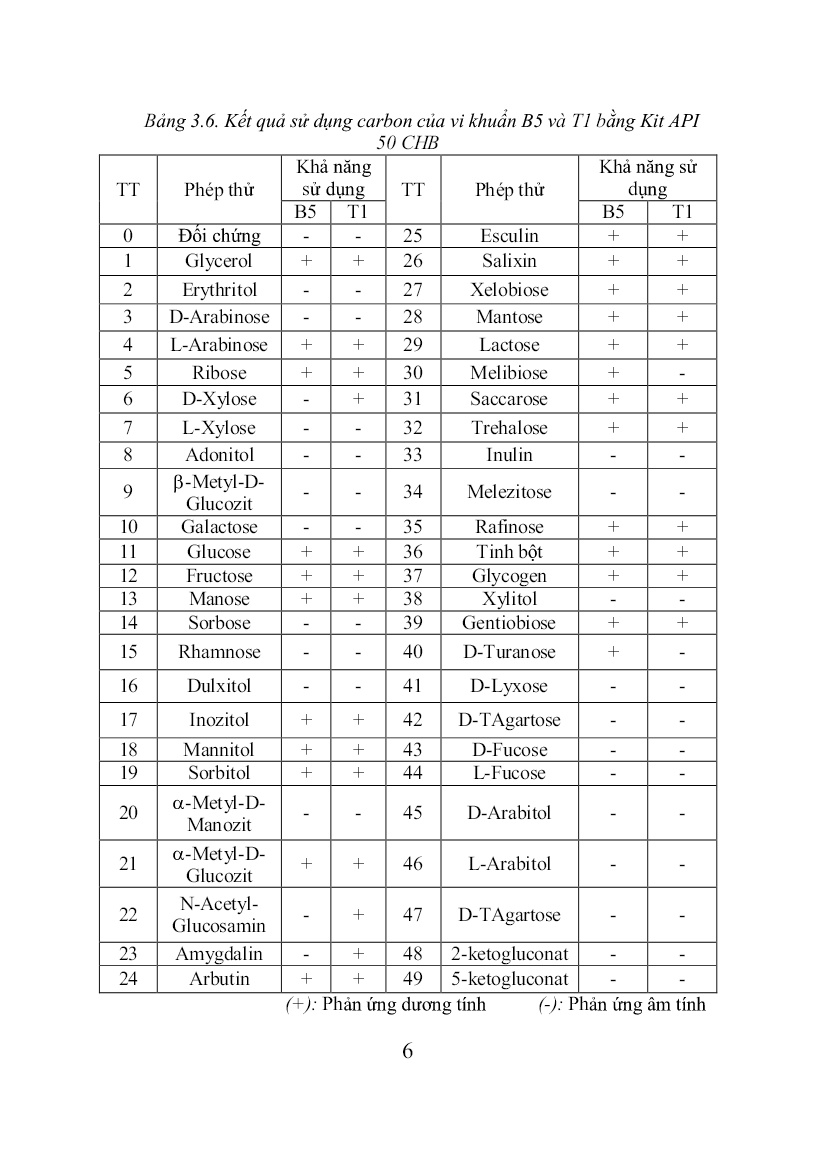
Trang 6

Trang 7

Trang 8
Trang 9

Trang 10
Tải về để xem bản đầy đủ
Bạn đang xem 10 trang mẫu của tài liệu "Tóm tắt Luận án Nghiên cứu sinh tổng hợp và thu nhận axit poly γ glutamic và hướng ứng dụng trong thực phẩm", để tải tài liệu gốc về máy hãy click vào nút Download ở trên.
Tóm tắt nội dung tài liệu: Tóm tắt Luận án Nghiên cứu sinh tổng hợp và thu nhận axit poly γ glutamic và hướng ứng dụng trong thực phẩm

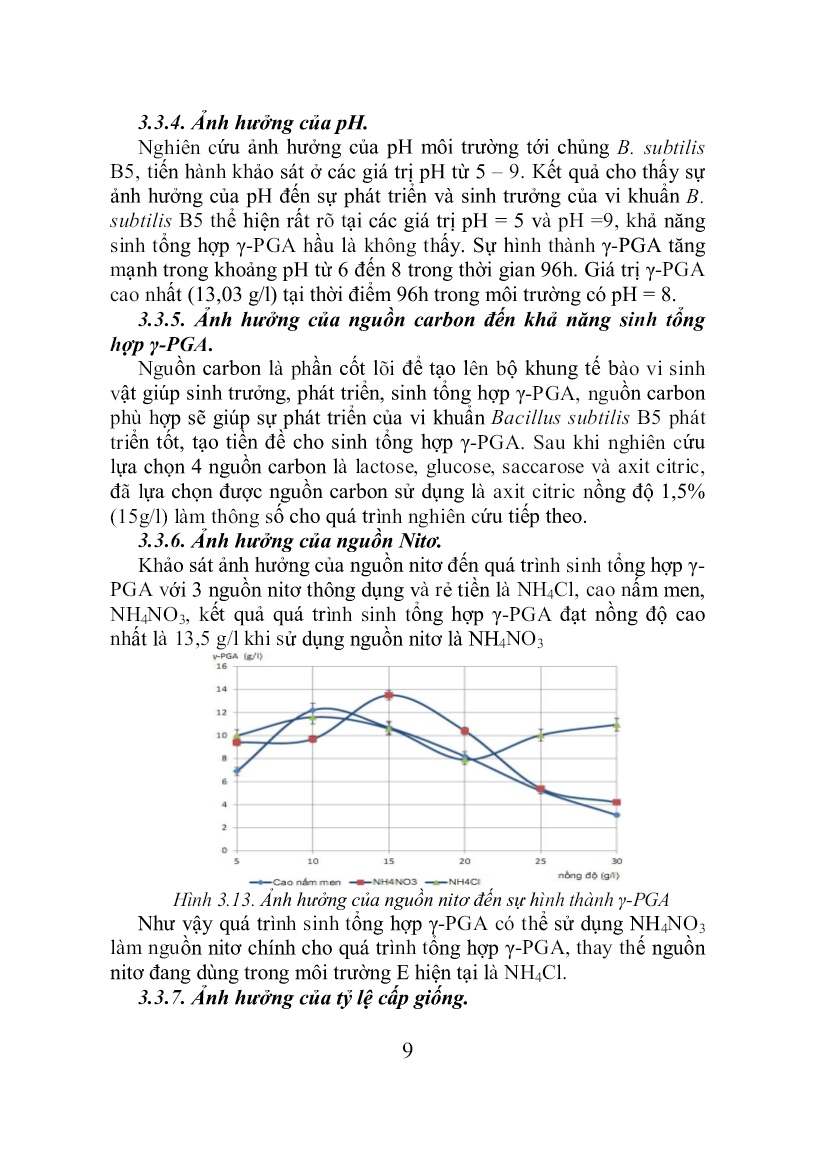
subtilis B5. Đối với chủng T1 sau khi định danh bằng phương pháp hóa sinh cho thấy có độ tương đồng là là 73% và phương pháp sinh học phân tử cho kết quả có độ tương đồng với B. subtilis C-3-9 (98- 99%) nên chưa thể kết luận chủng T1 thuộc loài B. subtilis 3.3. Nghiên cứu các yếu tố ảnh hưởng đến quá trình sinh tổng hợp γ-PGA 3.3.1.Nghiên cứu tiền chất thích hợp cho sinh tổng hợp γ-PGA Những nghiên cứu về sinh tổng hợp γ-PGA cho thấy tiền chất để tạo thành γ-PGA chủ yếu là hợp chất glutamic, glutamat hay bột đậu tương. Việc bổ sung đậu tương dạng bột vào canh trường lên men không làm tăng lượng γ-PGA, không những vậy khi bổ sung đậu tương còn gây ảnh hưởng lớn đến sự sinh trưởng của vi khuẩn, ảnh hưởng đến sự hình thành của γ-PGA. Trong môi trường có chứa natri glutamat, hàm lượng γ-PGA tạo thành cao hơn trong môi trường có 8 chứa glutamic. Như vậy có thể sử dụng natri glutamat làm nguồn tiền chất trong quá trình tạo γ-PGA thay thế cho axit glutamic trong toàn bộ quá trình nghiên cứu. 3.3.2. Ảnh hưởng của nhiệt độ B. subtilis là loài vi khuẩn ưa ấm có khả năng sinh trưởng và phát triển tốt ở dải nhiệt độ từ 30oC đến 45oC. Để có thể tìm ra một chế độ nhiệt thích hợp cho sinh tổng hợp γ-PGA, tiến hành sử dụng môi trường nghiên cứu có natri glutamat, trong điều kiện nuôi tĩnh, lên men tại các nhiệt độ 30oC; 35oC; 40oC và 45oC và 50oC để nuôi cấy, thu nhận kết quả 24h một lần, kết thúc quá trình lên men sau thời gian 120h. Kết quả nghiên cứu được thể hiện qua đồ thị hình 3.9. Kết quả nghiên cứu cho thấy chủng B. subtilis B5 có khả năng sinh tổng hợp γ-PGA cao nhất ở nhiệt độ 40oC, tạo ra γ-PGA đạt giá trị lớn nhất 9,07 g/l tại thời điểm 96h lên men. 3.3.3.Ảnh hưởng của tốc độ lắc. Tốc độ lắc của quá trình lên men được khảo sát ở tốc đô từ 0 – 200 v/p, tốc độ lắc là thông số đánh giá mức độ cung cấp khí cho môi trường lên men. Hình 3.9. Ảnh hưởng của nhiệt độ đến quá trình sinh tổng hợp γ-PGA Hình 3.10 Ảnh hưởng của tốc độ lắc đến quá trình sinh tổng hợp γ-PGA Kết quả biểu diễn ở hình 3.10 cho thấy: lượng γ-PGA đạt giá trị lớn nhất ở tốc độ 0 v/p (10,36 g/l ), khi tốc độ lắc càng cao xu hướng hình thành γ-PGA càng giảm. Đối với mẫu nuôi tĩnh do không tạo áp lực tác động lên lớp vỏ tế bào, nên sự hình thành γ-PGA không bị ảnh hưởng, việc cung cấp oxy hòa tan cho môi trường lên men trong bình tam giác của các mẫu thí nghiệm vừa đủ để vi khuẩn sinh trưởng và tổng hợp γ-PGA. Do vậy, phương án nuôi tĩnh được lựa chọn cho các quá trình nghiên cứu tiếp theo trên quy mô thí nghiệm. 9 3.3.4. Ảnh hưởng của pH. Nghiên cứu ảnh hưởng của pH môi trường tới chủng B. subtilis B5, tiến hành khảo sát ở các giá trị pH từ 5 – 9. Kết quả cho thấy sự ảnh hưởng của pH đến sự phát triển và sinh trưởng của vi khuẩn B. subtilis B5 thể hiện rất rõ tại các giá trị pH = 5 và pH =9, khả năng sinh tổng hợp γ-PGA hầu là không thấy. Sự hình thành γ-PGA tăng mạnh trong khoảng pH từ 6 đến 8 trong thời gian 96h. Giá trị γ-PGA cao nhất (13,03 g/l) tại thời điểm 96h trong môi trường có pH = 8. 3.3.5. Ảnh hưởng của nguồn carbon đến khả năng sinh tổng hợp γ-PGA. Nguồn carbon là phần cốt lõi để tạo lên bộ khung tế bào vi sinh vật giúp sinh trưởng, phát triển, sinh tổng hợp γ-PGA, nguồn carbon phù hợp sẽ giúp sự phát triển của vi khuẩn Bacillus subtilis B5 phát triển tốt, tạo tiền đề cho sinh tổng hợp γ-PGA. Sau khi nghiên cứu lựa chọn 4 nguồn carbon là lactose, glucose, saccarose và axit citric, đã lựa chọn được nguồn carbon sử dụng là axit citric nồng độ 1,5% (15g/l) làm thông số cho quá trình nghiên cứu tiếp theo. 3.3.6. Ảnh hưởng của nguồn Nitơ. Khảo sát ảnh hưởng của nguồn nitơ đến quá trình sinh tổng hợp γ- PGA với 3 nguồn nitơ thông dụng và rẻ tiền là NH4Cl, cao nấm men, NH4NO3, kết quả quá trình sinh tổng hợp γ-PGA đạt nồng độ cao nhất là 13,5 g/l khi sử dụng nguồn nitơ là NH4NO3 Hình 3.13. Ảnh hưởng của nguồn nitơ đến sự hình thành γ-PGA Như vậy quá trình sinh tổng hợp γ-PGA có thể sử dụng NH4NO3 làm nguồn nitơ chính cho quá trình tổng hợp γ-PGA, thay thế nguồn nitơ đang dùng trong môi trường E hiện tại là NH4Cl. 3.3.7. Ảnh hưởng của tỷ lệ cấp giống. 10 Tỷ lệ cấp giống là một trong những yếu tố ảnh hưởng đến quá trình lên men. Tỷ lệ cấp giống cao quá hay ít quá đều ảnh hưởng đến khả năng sinh tổng hợp. Nghiên cứu với các tỷ lệ cấp giống đến quá trình lên men dao động trong khoảng 1% đến 15% với thời gian lên men là 96h cho thấy: Lượng giống cấp với tỷ lệ 5% cho lượng γ- PGA lớn nhất là 16,48 g/l, ở hai tỷ lệ cấp giống 1% và 15% lượng γ- PGA tạo thành nhỏ nhất dao động trong khoảng 6 g/l. Vì vậy tỷ lệ cấp giống 5% được lựa chọn làm thông số cho các nghiên cứu tiếp theo. 3.3.8. Ảnh hưởng của nồng độ natri-glutamat Các nghiên cứu trên đã chỉ ra việc thay thế L-glutamic nồng độ 20 g/l bằng natri glutamat nồng độ 20 g/l. Sau khi thay đổi các điều kiện, môi trường, chế độ nuôi cấy, nồng độ γ-PGA tạo thành có phần cải thiện. Để tạo điều kiện cho sự hình thành γ-PGA là cực đại với nguồn tiền chất mới, nghiên cứu ảnh hưởng nồng độ tiền chất đến lượng γ-PGA hình thành cho thấy với nguồn tiền chất Natri – Glutamat với nồng độ 25 g/l sẽ tạo nên một lượng γ-PGA cao hơn khi sử dụng natri – glutamat ở nồng độ 20g/l và tạo thành γ-PGA = 20,5 g/l. 3.4. Tối ưu các điều kiện ảnh hưởng đến sinh tổng hợp γ-PGA Dựa vào số liệu đã khảo sát ảnh hưởng của các yếu tố nhiệt độ, thời gian, nồng độ tìền chất, pH, nguồn carbon, tỷ lệ cấp giống... và những nghiên cứu tối ưu hóa các yếu tố ảnh hưởng đến sự hình thành γ-PGA. Theo nguyên tắc của ma trận Box – Behnken, ta tiến hành 29 thí nghiệm với sự thay đổi đồng thời của bốn yếu tố quanh giá trị trung bình. Từ những phân tích phương sai, phần mềm đã đưa ra phương trình hồi quy theo giá trị thực của mô hình nghiên cứu như sau: Hàm lượng γ- PGA = - 2356,079 + 49,003X1 + 0,267X2 - 1,375X3 – 0,022X1X2 + 0,055X2X3 - 0,542X1X2 - 0,009X2X2 - 0,115X3X2 – 21,617X4X2 X1, X2, X3 và X4 là các yếu tố nhiệt độ, thời gian, tiền chất và pH bởi đây là những yếu tố ảnh hưởng nhiều đến quá trình sinh tổng hợp γ-PGA sau khi đã được khảo sát qua một số thí nghiệm. Giá trị chuẩn Fisher (F) là 24,70 và mô hình hoàn toàn có ý nghĩa với độ tin cậy 99,99% (p<0,0001), trong phép thử giá trị thông số 11 không phù hợp (Lack of Fit) giá trị p = 0,2043 (> 0,05) điều đó có nghĩa là mô hình này tương thích với thực nghiệm. Đánh giá dựa trên các giá trị hệ số xác định bội (R-square) và hệ số xác định bội hiệu chỉnh (Adj R-square), hai thông số đặc trưng cho mức độ phù hợp của mô hình trong việc giải thích các thí nghiệm. Trong nghiên cứu này giá trị R-square = 0,9611 và Adj R- square = 0,9222 đều > 0,9 điều đó chứng tỏ mô hình được lựa chọn là phù hợp để giải thích các kết quả nghiên cứu thí nghiệm. Mô hình cho thấy tương quan giữa yếu tố: nhiệt độ - thời gian; nhiệt độ - tiền chất, ảnh hưởng nhiều đến quá trình sinh tổng hợp γ-PGA. Hình 3.16. Biểu đồ bề mặt đáp ứng khi thời gian và nhiệt độ thay đổi Hình 3.17. Biểu đồ bề mặt đáp ứng khi nhiệt độ và tiền chất thay đổi Tối ưu hóa mô hình nghiên cứu. Hai trong 12 phương án tối ưu nhất trên lý thuyết được lựa chọn như sau: Phương án 1: Nếu xét trên góc độ tính toán để tối ưu hàm lượng γ-PGA hay nói cách khác đặt mức độ quan trọng của chỉ tiêu này đến mức cao nhất, phần mềm sẽ cho phương án sau thời gian 115,97 giờ, ở điều kiện pH ban đầu 8,04 hàm lượng tiền chất 30 g/l và nhiệt độ nuôi 39,41oC, thu được nồng độ γ-PGA cao nhất là 26,40 g/l và phương án có giá trị mong đợi (Desirability) là 0,978. Dựa trên kết quả tối ưu tiến hành thực nghiệm kiểm chứng ở nhiệt độ 39,5oC, pH = 8, nồng độ tiền chất 30g/l và với các điều kiện khác tương tự sau 116 giờ nuôi cấy nồng độ γ-PGA thu được là 26,04 g/l. Phương án 2: Nếu xét tính tối ưu để áp dụng được trong sản xuất quy mô lớn, cần phải xem xét về các yếu tố như thời gian ngắn, đầu vào nguyên liệu thấp, cho sản lượng tối ưu, tiến hành đặt các mức độ quan trọng của thời gian, tiền chất lên mức độ quan trọng nhất, sản lượng γ-PGA ở mức khá, nhiệt độ ở mức trung bình và các giá trị 12 ảnh hưởng ít là pH ở mức độ vừa phải. Sau khi chạy phần mềm tối ưu ta được các thông số nhiệt độ = 39,74oC; thời gian thu nhận 97,02 giờ; nồng độ tiền chất 25 g/l và pH=8,0 và hàm lượng theo phần mềm tính tinh toán là 23,71 g/l phương án đạt giá trị mong đợi là 1,000. Dựa trên kết quả tính toán lý thuyết, tiến hành thực nghiệm kiểm chứng với các thông số nhiệt độ 40oC, pH = 8 và nồng độ tiền chất = 25 g/l sau thời gian 97 giờ thu nhận được γ-PGA có nồng độ 25,02 g/l cao hơn với tính toán lý thuyết là 1,31 g/l. So sánh hai phương án đưa ra theo tối ưu hóa trên lý thuyết và thực nghiệm ta thấy, thời gian chênh lệch giữa 2 phương án là 19 giờ (giảm 16%), chênh lệch tiền chất 5 g/l (giảm 16,7%) hàm lượng γ- PGA thu được chênh lệch 1,02 g/l (tăng 3,9%). Như vậy xét trên góc độ hiệu quả kinh tế phương án 2 là tối ưu hơn phương án 1. Do vậy phương án 2 với các thông số nghiên cứu: nhiệt độ 40oC, pH = 8 và nồng độ tiền chất = 25 g/l sau thời gian 97 giờ thu nhận γ-PGA = 25,02 g/l là phương án được chọn cho các nghiên cứu sau của đề tài. 3.5. Nghiên cứu động học của quá trình lên men Trước khi đi vào nghiên cứu sinh tổng hợp γ-PGA trên quy mô pilot (100lít/mẻ) tiến hành nghiên cứu động học quá trình lên men này trên quy mô phòng thí nghiệm BioTron quy mô 5-7 lít/mẻ, kết quả được biểu diễn trên hình 3.20: Hình 3.20: Đồ thị biểu diễn động học quá trình tổng hợp γ-PGA Kết quả cho thấy, quá trình sinh trưởng của chủng B5 theo 4 giai đoạn. Từ 0 đến 24h sinh khối tế bào tăng chậm, giai đoạn này chủng B5 thích ứng dần với môi trường lên men, có thể khẳng định đây là pha tiềm phát. Giai đoạn từ 24h đến 72h sinh khối tế bào tăng rất mạnh từ 15,1 đến 54,6 g/l, cho thấy tế bào sinh sản rất nhanh, chất dinh dưỡng chủ yếu được tổng hợp sinh khối. Trong khoảng thời 13 gian từ 72h-120h, quần thể đi vào pha cân bằng, sinh khối tế bào giữ ở mức ổn định số tế bào chết bằng số tế bào được sinh ra. Giai đoạn cuối từ 120h đến 144h sinh khối thế bào bắt đầu giảm, có thể do chứa nhiều chất trao đổi thứ cấp gây ức chế sinh trưởng, môi trường dinh dưỡng dần cạn kiệt Quá trình sinh tổng hợp PGA tăng mạnh từ 72 đến 96h và bắt đầu giảm khi đi vào cuối pha cân bằng. Điều này có thể thấy sự tạo thành sinh khối mạnh sau 48h lên men đã tạo ra lượng enzym PGA synthetase lớn làm xúc tác cho quá trình tổng hợp γ-PGA. Trong giai đoạn cuối pha cân bằng một phần γ-PGA được vi khuẩn sử dụng làm chất dinh dưỡng nên hàm lượng giảm. Trong toàn bộ quá trình sinh trưởng và phát triển, giá trị pH của môi trường hầu như không thay đổi so với giá trị ban đầu. 3.6. Nghiên cứu các yếu tố ngoại cảnh đến sinh tổng hợp γ- PGA của chủng B5 ở quy mô 100 lít/mẻ 3.6.1. Ảnh hưởng của chế độ khuấy và sục khí. Đánh giá mức độ phát triển của vi sinh vật trong canh trường bằng cách đó mật độ quang OD ở bước sóng 600nm ở thời gian 96h, kết quả được thể hiện trong bảng 3.9: Bảng 3.9. Ảnh hưởng của khuấy và sục khí đến mật độ vi khuẩn (CFU/ml) Chế độ cấp khí 0h 24h 48h 72h 96h γ-PGA (g/l) Tĩnh 1x106 4x106 5x108 7x103 2x102 3,8 ±0,02 Khuấy 350 v/p 1x106 7x108 1x109 1x109 4x107 19,7±0,03 Sục khí 10lít/phút 1x106 8x108 2x109 1x109 5x107 24,1±0,02 Khuấy 350 v/p + sục khí 10 l/ph 1x106 2x109 6x109 1x109 7x107 25,3±0,05 Qua kết quả trong bảng 3.9 nhận thấy: khi nghiên cứu tại quy mô 100 lít/mẻ, nếu xét ở góc độ năng suất cao, nên kết hợp cả phương pháp khuấy trộn và sục khí thì khả năng sinh tổng hợp γ-PGA sẽ cao hơn so với các phương pháp lên men tĩnh, khuấy hoặc sục khí. 3.6.2. Sự thay đổi của hàm lượng oxy hòa tan trong quá trình lên men. Khảo sát cho thấy nồng độ oxy hòa tan trong thiết bị lên men giảm mạnh trong thời gian từ 0 đến 24h và nồng độ oxy hòa tan ở giai đoạn 24 đến 48h rất thấp, sự tiêu thụ oxy cho quá trình sinh 14 trưởng và phát triển của vi khuẩn làm lượng oxy hòa tan trong dịch giảm xuống cực tiểu, đồng nghĩa với sự sinh trưởng của vi sinh vật đạt cực đại. Sau 48h quá trình tổng hợp γ-PGA đi vào giai đoạn tăng trưởng, quá trình sinh trưởng và phát triển của vi khuẩn đi vào giai đoạn suy thoái. Sau 72h nồng độ γ-PGA và độ nhớt dịch lên men tăng đến giá trị cực đại, kìm hãm sự phát triển của vi khuẩn, gây ức chế sự phát triển của vi khuẩn, rất ít oxy được sử dụng. Trong giai đoạn này các đơn phân glutamic và các muối của nó được chuyển hóa thành các chuỗi polyme γ-PGA. 3.7. Nghiên cứu một số phương án tinh sạch γ-PGA Quá trình tinh sạch của γ-PGA được sử dụng để nghiên cứu dựa trên những công bố khoa học của nước ngoài với 3 phương pháp đã được công bố, các phương pháp được lựa chọn với mục các tiêu chí: 3.7.1. So sánh phương pháp tinh sạch dựa trên tiêu chí hàm lượng protein và carbonhydrat Các mẫu nghiên cứu thu được, tiến hành tinh sạch trên 3 phương pháp đã được quốc tế công bố, sau đó kiểm tra hàm lượng protein, carbonhydrate và hiệu suất thu hồi sau khi tinh sạch. Thu được kết quả trong bảng 3.10 sau: Bảng 3.10: Hàm lượng protein và carbonhydrat còn lại sau khi tinh sạch γ-PGA Mẫu Carbonhydrat (µg/g) Hàm lượng Protein (µg/g) Hiệu suất (%) PP 1 8,1 6,39 78 PP 2 8,4 5,75 77 PP 3 9,6 7,01 73 Dựa trên những qui trình, kết quả sau khi tinh sạch có thể lựa chọn phương pháp 1 làm phương pháp tinh sạch cho các nghiên cứu sau. Nếu sử dụng cách này sẽ không phải sử dụng nhiều cồn và các hóa chất gây hại cho cơ thể, môi trường (NaOH, HCl) như các phương pháp còn lại. 3.7.2. Nghiên cứu đánh giá cảm quan sản phẩm γ-PGA sau khi tinh sạch Đánh giá cảm quan và thông số độ nhớt cho các mẫu nghiên cứu thấy phương pháp 1 có sử dụng than hoạt tính và celite (đất hoạt tính) hai tác nhân này có tác dụng hấp thụ màu và hấp thụ mùi của 15 các sản phẩm nên không có mùi lạ như các phương pháp còn lại. Do vậy phương pháp tinh sạch γ-PGA được lựa chọn cho các nghiên cứu tiếp theo là phương pháp 1 như sau: Hình 1.4. Quy trình tinh sạch γ-PGA theo phương pháp của Ho và cộng sự 3.7.3. Kiểm tra mức độ tinh sạch của sản phẩm bằng phương pháp sắc ký lỏng cao áp (HPLC) Để đánh giá mức độ tinh sạch của sản phẩm, ngoài việc kiểm tra protein, carbonhydrat có trong sản phẩm sau tinh sạch, ta còn có thể kiểm tra các axit amin còn lại sau quá trình tinh sạch bằng phương pháp sắc ký lỏng cao áp sản phẩm γ-PGA. Kết quả sắc ký cho thấy có sự hiển diện của axit L-glutamic, ngoài ra chỉ có 1 peak nhỏ thể hiện sự lẫn tạp chất trong sản phẩm sau thủy phân, hình 3.22. 3.7.4. Đánh giá chất lượng sản phẩm tinh sạch qua kính hiển vi điện tử quét Mẫu thô do vẫn còn lẫn nhiều tạp chất trong đó nên cấu trúc γ- PGA chưa được hiển thị rõ cấu trúc là các khối, sự hiển thị chỉ nhìn thấy dưới dạng phẳng hai chiều, không làm nổi rõ các cấu trúc phân tử của γ-PGA như ở mẫu tinh sạch và mẫu chuẩn. Giữa các mẫu tinh sạch và mẫu chuẩn thấy sự rõ nét của các cấu trúc γ-PGA dưới dạng không gian ba chiều. Mẫu tinh sạch thể hiện là các cụm nhỏ liên kết với nhau thành nhiều đám rời rạc tạo ra những khoảng trống, mẫu 16 chuẩn cũng là những cụm nhỏ có hình bất định liên kết với nhau, tuy nhiên sự liên kết này chặt chẽ và ít tạo khoảng trống, làm cho cấu trúc nhìn trông mịn và liền khối. Hình 3.24. Ảnh chụp cấu trúc γ-PGA bằng kính hiển vi điện tử quét độ phóng đại 100.000 lần A-mẫu γ-PGA thô; B- mẫu γ-PGA sau tinh sạch; C- mẫu γ-PGA kiểm chứng 3.7.5. Xác định cấu trúc và độ sạch của γ-PGA thông qua phổ FT-IR và phổ H NMR. Các phổ FT-IR và H NMR của γ-PGA sau tinh sạch thu được bởi chủng Bacillus subtilis B5 cho thấy: có sự thể hiện của gốc muối carboxyl (COO- giãn bất đối xứng) trong mẫu γ-PGA được phân tích, phổ cũng thể hiện sự hình thành của liên kết C=O tuy nhiên bị che bởi peak giãn của COO-. Tiếp đến là các giải phổ này có liên quan đến các liên kết của nhóm NH; CH3; COO-; γ-CH2; α-CH2 và các nhóm chức khác của γ-PGA. Những kết quả trên cũng cho thấy sự kết hợp giữa hai phổ FT –IR và phổ H NMR để đánh giá cấu trúc phân tử γ-PGA là tương đối giống nhau. Hình 3.22. Sắc ký đồ HPLC mẫu γ- PGA thủy phân thành glutamic. Hình 3.27. Phổ H NMR của γ-PGA tinh sạch thu được bởi chủng B.subtilis B5 3.8. Nghiên cứu một số đặc tính của γ-PGA 3.8.1. Xác định khối lượng phân tử 17 Nghiên cứu xác định khối lượng phân tử của các mẫu γ-PGA bằng phương pháp điện di trên SDS Page các mẫu sau khi tinh sạch cho thấy khối lượng phân tử các mẫu sau khi chạy điện di với marker hiển thị màu chuẩn có thể xác định được khối lượng phân tử của γ- PGA lớn hơn 176 kDa. Đánh giá khối lượng phân tử trung bình của sản phẩm γ-PGA trên sắc ký lọc gel (GPC) kết quả được sau khi tính toán dựa trên peak thu nhận được khối lượng phân tử trung bình Mw của γ-PGA dao động trong khoảng từ 158 – 426 Kda. Đối chiếu và so sánh với các nghiên cứu về γ-PGA tạo ra bởi chủng Bacillus subtilis cho thấy thông thường có khối lượng phân tử từ 100 – 1.500 kDa. 3.8.2. Tỷ lệ đồng phân D – Glutamic và L – Glutamic trong γ- PGA Từ γ-PGA được tạo thành từ B. subtilis B5 sau khi thủy phân băng axit và làm sạch sản phẩm đến độ tinh khiết nhất định, tiến hành đo độ phân cực của hỗn hợp đồng phân quang học D và L glutamic. Sau khi tinh toán cho thấy tỷ lệ D:L glutamic axit là 47,97/52,03 trong hỗn hợp poly γ glutamic axit sản sinh bởi B. subtilis B5. Kết quả này cũng một lần nữa khẳng định cho nguồn gốc chủng giống sinh tổng hợp γ-PGA là B. subtilis. 3.8.3. Nghiên cứu tính bền axit của γ-PGA. Nghiên cứu thử nghiệm ảnh hưởng tính chất của γ-PGA trên các môi trường axit citric có nồng độ từ 0 – 30g/l qua việc xác định độ nhớt của dịch thử nghiệm để đánh giá mức độ ảnh hưởng của nồng độ axit đến chất lượng ổn định sản phẩm của γ-PGA tại nồng độ 1 g/l. Bảng 3.14. Ảnh hưởng của axit đến tính chất của sản phẩm γ-PGA Axit citric (g/l) 0 5 10 15 20 25 30 pH 7 3,45 2,94 2,74 2,6 2,46 2,38 Độ nhớt (cp) 4,5 ± 0,04 4,0 ± 0,03 4,0 ± 0,03 3,5 ± 0,02 3,0 ± 0,01 2,5 ± 0,01 3,0 ± 0,01 Kết quả khi nồng độ axit tăng (độ pH giảm) khả năng tạo nhớt của γ-PGA giảm đi, đến nồng độ axit 20g/l sự biến đổi độ nhớt không có sự thay đổi nhiều. Qua khảo sát này kết luận có thể sử dụng γ-PGA trong các sản phẩm đồ uống có độ axit cao. 3.8.4. Nghiên cứu tính bền nhiệt của γ-PGA 18 Để tìm hiểu về ảnh hưởng của nhiệt độ đến độ nhớt của γ-PGA hay tính bền nhiệt, tiến hành nghiên cứu với γ-PGA nồng độ 1 g/l để ở các nhiệt độ 25oC; 50oC; 75oC; 100oC và 125oC trong thời gian 30 phút. Hình 3.31. Ảnh hưởng của nhiệt độ đến sự biến đổi độ nhớt của dịch γ-PGA Kết quả nghiên cứu chỉ ra rằng độ nhớt γ-PGA tỷ lệ nghịch với nhiệt độ, khi bị tác động của nhiệt độ càng cao độ nhớt của γ-PGA càng giảm. Mức độ giảm độ nhớt của γ-PGA là rất nhỏ trong khoảng nhiệt độ từ 75-100oC. Đây cũng là một đặc tính ưu việt khi sử dụng γ-PGA áp dụng cho mỗi loại sản phẩm trong thực tế. 3.9. Nghiên cứu hoàn thiện chế phẩm γ-PGA 3.9.1. Nghiên cứu các thông số cho sấy phun chế phẩm γ-PGA Sau khi nghiên cứu trên thực nghiệm thu được kết quả sấy phun tốt nhất đối với chế phẩm γ-PGA trong bảng 3.14: Bảng 3.14. Các thông số sấy phun cho chế phẩm γ-PGA 3.9.2. Đánh giá mức độ an toàn của γ-PGA trong việc sử dụng làm phụ gia thực phẩm. Căn cứ theo quy chuẩn kỹ thuật quốc gia (QCVN 4- 21:2011/BYT) về phụ gia thực phẩm – với các loại phụ gia chất làm dày. Căn cứ vào công bố sử dụng γ-PGA sản xuất từ vi khuẩn B. Chỉ tiêu Thông số Chất trợ sấy: Maltodextrin 5% Nhiệt độ sấy 160 oC Tốc độ đĩa phun 11.00-12.000 v/ph Hiệu suất thu hồi 85,8 -90,4% Lưu lượng dịch cấp 5 lít/h Đánh giá cảm quan Bột khô, hút ẩm chậm, màu trắn
File đính kèm:
 tom_tat_luan_an_nghien_cuu_sinh_tong_hop_va_thu_nhan_axit_po.pdf
tom_tat_luan_an_nghien_cuu_sinh_tong_hop_va_thu_nhan_axit_po.pdf

